Doktorgradsavhandling: Legemiddelinformasjon ved graviditet
- Publicerad: 23.06.2014
HOVEDBUDSKAP
- Produsentavhengige og produsentuavhengige kilder gir ulik informasjon vedrørende legemiddelbruk i graviditet
- Gravide vurderer risikoen ved å bruke legemidler høyere enn fastleger
- Råd fra RELIS (produsentuavhengige legemiddelinformasjonssentre) kan påvirke legens valg av terapi for den gravide pasienten
BAKGRUNN OG HENSIKT
Mange gravide bruker legemidler mot svangerskapsrelaterte plager som kvalme eller halsbrann. Andre har kroniske sykdommer som epilepsi eller migrene, eller får akutte symptomer som hodepine eller infeksjoner (1). Både gravide og deres leger trenger derfor legemiddelinformasjon for å vurdere fordeler og risiko med å bruke medisiner (2, 3).
Det er anslått at kun 1% av fosterskader er forårsaket av mors legemiddelbruk. Legemidler blir imidlertid ofte antatt å ha en betraktelig høyere risiko enn dette (4), noe som bidrar til skepsis for legemidler som har stor nytteverdi og lav risiko for mor og foster.
Mange informasjonskilder beskriver risiko vedrørende legemiddelbruk ved graviditet, og den enkeltes oppfattelse av informasjonen påvirker valg om bruk av legemidler. I dette doktorgradsprosjektet ble behov for og holdninger til legemiddelinformasjon ved graviditet undersøkt blant leger og gravide kvinner.
MATERIALE OG METODER
Doktorgradsprosjektet besto av fire delstudier. Den første var en deskriptiv studie som sammenlignet råd om legemiddelbruk ved graviditet i Felleskatalogen med råd basert på henvendelser til RELIS, de norske produsentuavhengige legemiddelinformasjonssentrene.
Den andre delstudien var en spørreundersøkelse blant leger som hadde stilt spørsmål til RELIS angående legemiddelbruk hos gravide pasienter. Det ble bl.a. undersøkt hvor fornøyd legen var med svaret og om svaret hadde hatt konsekvenser for behandlingen av den gravide.
I den tredje delstudien ble det gjennomført intervjuer med gravide kvinner som hadde epilepsi og som brukte antiepileptika. Behov for legemiddelinformasjon, samt risikooppfattelse relatert til legemidler i graviditet, var hovedtemaene for intervjuene.
Den siste delstudien var en spørreundersøkelse blant gravide og deres respektive fastleger. Både gravide og leger vurderte risiko med legemidler og trygghet på å bruke legemidler. Vurderingene var basert på 6 tekster (Figur 1) om graviditet hentet fra pakningsvedlegg, introduserte med situasjonsbeskrivelser. Indikasjonen for bruk av legemidlet, men ikke navnet på legemidlet, var angitt.
RESULTATER
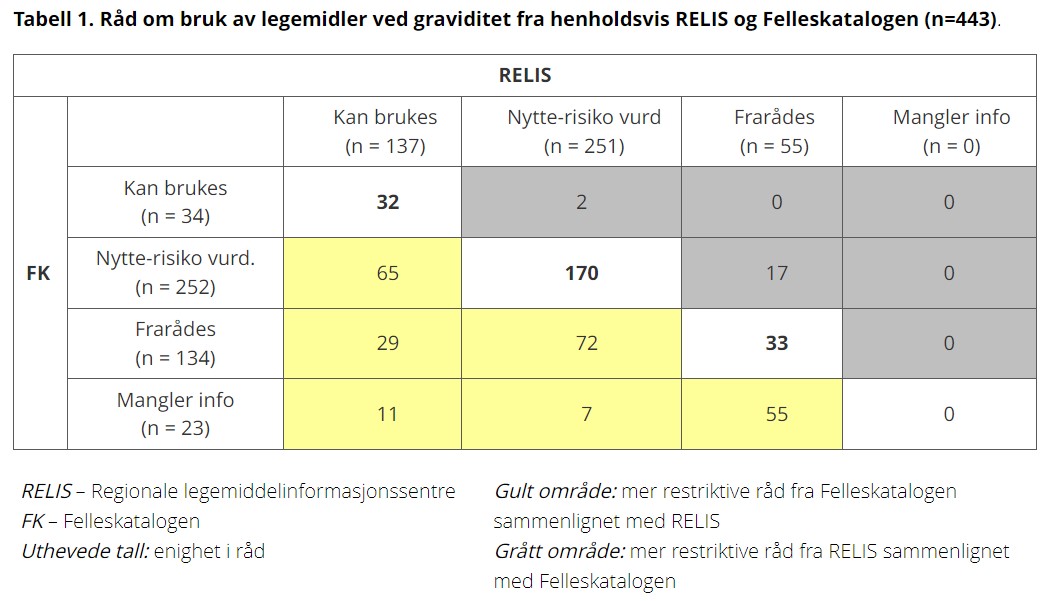
Delstudie 1: For 47% av 443 legemiddelråd som ble sammenlignet var det forskjell mellom RELIS og Felleskatalogen (Tabell 1). Det var signifikant (p < 0,01) mer restriktive råd i Felleskatalogen. Syv av 10 av de legemidlene som RELIS hyppigst var spurt om var legemidler som virker på nervesystemet, og 4 av disse var selektive serotoninreopptakshemmere (SSRI).
Delstudie 2: Spørreskjemaer besvart av 117 leger (76% svar) ble inkludert i studien. Legene var i stor grad fornøyde med svaret fra RELIS og ville anbefale kollegaer å bruke denne tjenesten. Nittito prosent av legene oppga at svaret fra RELIS hadde hatt konsekvenser for behandlingen av den gravide pasienten, og 9% oppga at svaret hadde bidratt til å unngå uønsket abort.
Delstudie 3: Ti gravide kvinner med epilepsi ble intervjuet. Kvinnene valgte å ta epilepsimedisin heller enn å risikere å få epileptiske anfall. De var imidlertid bekymret for påvirkning på barnet ved doseøkning av epilepsimedisinen under graviditeten. Flere kvinner var restriktive med å bruke andre medisiner, f.eks. mot hodepine eller allergi, som har lav fosterskadelig risiko. Mange oppga å ha begrenset behov for legemiddelinformasjon, blant annet på grunn av langvarig bruk av epilepsimedisin.
Delstudie 4: 171 gravide kvinner (58% svar) og 74 fastleger (62% svar) ble inkluderte. De gravide vurderte den fosterskadelige risikoen som signifikant (p < 0,05) høyere sammenlignet med deres respektive lege og de gravide var signifikant (p < 0,05) mindre trygge på å bruke alle legemidlene. Forskjellen mellom gravides og legers vurderinger var størst for teksten som gjaldt et antidepressivt legemiddel, og begge gruppene vurderte fosterskadelig risiko med denne teksten til å være blant de høyeste av alle tekstene.
| Legemiddel mot urinveisinfeksjon:
”Rådfør deg med lege eller apotek før du tar noen form for medisin. Lang erfaring lved bruk av dette egemiddel under graviditet har ikke vist skadelige effekter. Det bør allikevel utvises forsiktighet med å behandle gravide i et lengre tidsrom enn 2 uker på grunn av risiko for utvikling av karnitinmangel*.” *Karnitinmangel = muskelsvakhet |
| Legemiddel mot svangerskapskvalme (1. trimester)
”Rådfør deg med lege eller apotek før du tar noen form for medisin. Risiko ved bruk under graviditet er liten. Det er ikke påvist fosterskadelige effekter ved bruk av dette legemiddel som kvalmestillende middel hos gravide. Andre typer av denne gruppen legemidler har i høye doser i 3. trimester vist langvarige, forbigående nevrologiske forstyrrelser hos barnet. Dette legemiddel bør derfor ikke brukes i de 3 siste månedene av svangerskapet.” |
| Smertestillende mot ryggsmerter
”Rådfør deg med lege eller apotek før du tar noen form for medisin. Lang erfaring med bruk av dette legemiddelet under graviditet har ikke vist skadelige effekter. Rådfør deg likevel med lege før bruk av dette legemiddelet dersom du er gravid.” |
| Legemiddel mot depresjon (1.trimester)
”Informer legen din hvis du er gravid eller planlegger å bli det. Bruk ikke dette legemiddel hvis du er gravid uten at du og legen har diskutert fordeler og risiko. Hvis du bruker dette legemiddel de siste 3 månedene av svangerskapet skal du være oppmerksom på at følgende effekter kan sees hos det nyfødte barnet: pustevansker, blålig hud, kramper, endringer i kroppstemperatur, vanskeligheter med amming, oppkast, lavt blodsukker, stive eller slappe muskler, økte reflekser, skjelvinger, irritabilitet, døsighet, konstant gråt, søvnighet eller søvnvansker. Hvis det nyfødte barnet har noen av disse symptomene må du kontakte lege umiddelbart. Hvis dette legemiddelet brukes under graviditet skal behandlingen aldri avsluttes brått.” |
| Naturlegemiddel mot søvnproblemer
”Skal ikke brukes av gravide og ammende, da risiko ved graviditet og amming ikke er klarlagt.” |
| Legemiddel mot pollenallergi
”Ingen uheldige effekter på fosteret er vist.” |
Figur 1. Tekster om legemiddelbruk ved graviditet hentet fra pakningsvedlegg, som angitt på spørreskjemaer i delstudie 4.
DISKUSJON
Det ble funnet betydelige forskjeller mellom råd om graviditet i produsentkilden Felleskatalogen og den produsentuavhengige kilden RELIS. Dette kan forklares ut fra at råd fra RELIS er baserte på medisinske vurderinger, mens råd i Felleskatalogen i stor grad er begrenset av juss og myndighetskrav. Siden det kan være tilfeldig hvilken kilde som brukes av helsepersonell som rådgir gravide, og Felleskatalogen er hyppig brukt blant leger (5), kan forskjellene påvirke riktige valg om bruk av legemidler. Helsepersonell bør derfor være kjent med egenartene til de ulike kildene.
RELIS ble funnet å kunne påvirke legers terapivalg til gravide pasienter, noe som kan indikere at RELIS kan medvirke til rasjonell legemiddelbruk ved graviditet. Dette støttes også av forskning fra andre legemiddelinformasjonssentre (6).
Gravide med epilepsi hadde økt risikooppfattelse relatert til doseøkning av antiepileptika og bruk av andre legemidler. Gravide hadde også en signifikant høyere risikooppfattelse enn leger angående legemiddelbruk. En mulig forklaring kan være at ulikt ståsted gir ulik måte å vurdere risiko på. En høy risikooppfattelse av legemiddelbruk kan skyldes generelt fokus i samfunnet og i media på risiko knyttet til bruk av legemidler (7), og forventninger om at gravide ikke skal utsette det ufødte barnet for noe som potensielt kan være skadelig. Urealistiske risikooppfattelser om legemiddelbruk under graviditet kan ha konsekvenser i form av valg om terapi og etterlevelse til valgt behandling (8).
I delstudie 4 ble teksten som beskrev et antidepressivum vurdert å ha høy fosterskadelig risiko og lav grad av trygghet. Dette var den lengste av alle tekstene og den inneholdt en detaljert beskrivelse av effekter som kan ses på det nyfødte barnet (se Figur 1). Dette indikerer at formulering av informasjon kan påvirke valg om bruk av legemidler under graviditet (9).
Dette doktorgradsprosjektet er basert på arbeidserfaring fra et legemiddelinformasjonssenter (RELIS), noe som vil ha påvirket valg av metoder og hensikt for de ulike delstudiene. I spørreundersøkelsene kan vi ikke utelukke at det var de leger og gravide som hadde høyest interesse for temaet som deltok.
KONKLUSJON
Resultatene fra dette doktorgradsprosjektet indikerer at formulering av legemiddelinformasjon, forekomst av forskjeller i informasjon mellom ulike kilder og tilgang til produsent-uavhengig legemiddelinformasjon kan påvirke leger og gravides valg om bruk av legemidler under graviditet.
Referenser
- Feibus KB. FDA’s proposed rule for pregnancy and lactation labeling: improving maternal child health through well-informed medicine use. J Med Toxicol 2008; 4(4): 284-8.
- Nordeng H, Ystrom E, Einarson A. Perception of risk regarding the use of medications and other exposures during pregnancy. Eur J Clin Pharmacol 2009; 66(2): 207-14.
- Morgan MA, Cragan JD, Goldenberg RL et al. Obstetrician-gynaecologist knowledge of and access to information about the risks of medication use during pregnancy. J Matern Fetal Neonatal Med 2010; 23(10): 1143-50.
- Webster WS, Freeman JA. Prescription drugs and pregnancy. Expert Opin Pharmacother 2003; 4(6): 949-61.
- Hoye S, Straand J, Brekke M. Hvordan holder allmennleger seg oppdatert om legemidler? Tidsskr Nor Laegeforen 2008; 128(23): 2692-5.
- Hedegaard U, Damkier P. Problem-oriented drug information: physicians’ expectations and impact on clinical practice. Eur J Clin Pharmacol 2009; 65(5): 515-22.
- Polifka JE, Faustman EM, Neil N. Weighing the risks and the benefits: a call for the empirical assessment of perceived teratogenic risk. Reprod Toxicol 1997; 11(4): 633-40.
- McDonald K, Amir LH, Davey MA. Maternal bodies and medicines: a commentary on risk and decision-making of pregnant and breastfeeding women and health professionals. BMC Public Health 2011;11 Suppl 5:S5.
- Koren G. The way women perceive teratogenic risk. Can J Clin Pharmacol 2007; 14(1): e10-6.
