Er celekoksib tryggere enn ikke-selektive NSAIDs?
- Publicerad: 29.06.2017
Kardiovaskulær sikkerhet av koksiber, men også ikke-selektive NSAIDs har vært omdiskutert siden rofekoksib (Vioxx) ble trukket fra markedet grunnet økt risiko for kardiovaskulære hendelser. Flere store studier har undersøkt denne problemstillingen, og vi har gjort en gjennomgang av nylig publiserte kliniske studier, metaanalyser og oversiktsartikler.
Er kardiovaskulære bivirkninger av NSAIDs relatert til COX-2-selektivitet?
En tidligere metaanalyse fant at koksiber økte risikoen for alvorlige kardiovaskulære hendelser med om lag en tredjedel. Bruk av høye doser diklofenak og ibuprofen medførte en lignende risikoøkning, mens det ikke ble observert tilsvarende risikoøkning for naproksen (1). Risiko for kardiovaskulære bivirkninger av NSAIDs har vært forbundet med grad av COX-2-selektivitet (1-4), men nyere data har sådd tvil om denne årsakssammenhengen etter at det har blitt observert økt risiko for kardiovaskulære bivirkninger også ved bruk av ikke-selektive NSAIDs (1-2, 5-6). Flere har påpekt at rofekoksib skiller seg ut med hensyn til kardiovaskulær risiko, og at bidraget fra rofekoksib kan ha gitt feilaktig resultat ved sammenligning av risiko mellom koksiber og ikke-selektive NSAIDs (2, 7).
Nyere metaanalyser har konkludert med at COX-2-selektivitet trolig ikke spiller en avgjørende rolle med hensyn til kardiovaskulær risiko forbundet med NSAIDs (2, 7). En stor bayesiansk metaanalyse fant økt risiko for hjerteinfarkt for alle NSAIDs, inkludert for naproksen. Det ser ut til at risikoen øker umiddelbart ved eksponering og er høyest den første behandlingsmåneden. Samtidig ble det sett økt risiko ved økende doser. Det ble ikke observert høyere risiko for celekoksib sammenlignet med ikke-selektive NSAIDs (2). Samtidig har det i tidligere studier heller ikke blitt observert økt risiko for kardiovaskulære bivirkninger av celekoksib ved lavere doser, mens risikoen har økt ved økende dose (8, 9).
Er diklofenak et ikke-selektivt NSAID?
Relativ selektivitet for COX-1 og COX-2 for naproksen, ibuprofen, diklofenak og celekoksib er illustrert i figur 1 (3). Av de mest brukte NSAIDs har naproksen lavest affinitet for COX-2. Ibuprofen er også relativt ikke-selektivt, mens celekoksib er en intermediær COX-2-selektiv hemmer. På tross av at diklofenak ikke er klassifisert som et koksib, viser analyser COX-2-selektivitet nær celekoksib. I metaanalyser er det sett økt risiko for kardiovaskulære bivirkninger av diklofenak sammenlignet med ibuprofen og naproksen (1). Rofekoksib er en sterkt COX-2-selektiv hemmer.
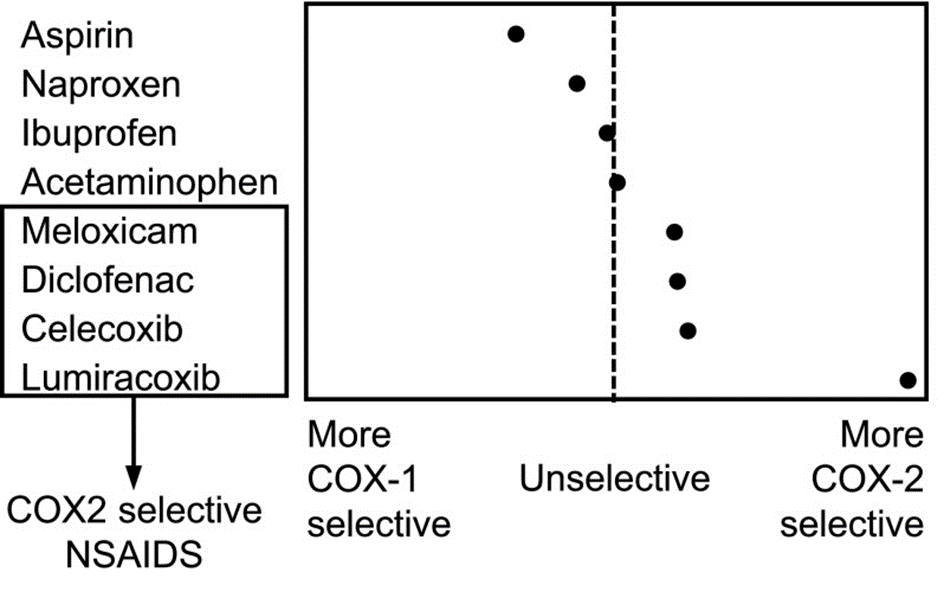
Figur 1: Grad av selektivitet for COX-1 og COX-2 for ulike NSAIDs, hentet fra Angiolillo DJ et al (3).
Det siste året har det blitt publisert resultater fra to store kliniske studier der kardiovaskulær risiko ved bruk av celekoksib er undersøkt (5, 6).
PRECISION-studien: Celekoksib til pasienter med kardiovaskulær risiko
I USA ble det påført advarsel om kardiovaskulær risiko ved bruk av NSAIDs, men koksiber ble ikke kontraindisert ved hjerte-/karsykdom. Dette gjorde det mulig å gjennomføre en fase 4-studie i USA og en rekke land utenfor EU med hensyn til kardiovaskulær risiko av celekoksib for pasienter med etablert kardiovaskulær sykdom, PRECISION-studien. Dosering av celekoksib var av regulatoriske hensyn begrenset til 200 mg daglig til pasienter med osteoartritt. Ved revmatoid artritt er celekoksib i USA godkjent i dosering opp til 400 mg daglig (5).
PRECISION-studien ble initiert av Pfizer, produsenten av Celebra/Celebrex (celekoksib) i 2004 etter pålegg fra amerikanske legemiddelmyndigheter, FDA. Denne randomiserte, kliniske studien har undersøkt bruk av celekoksib, ibuprofen og naproksen hos nærmere 25 000 pasienter med risikofaktorer for kardiovaskulær sykdom med det formål å avklare hvorvidt celekoksib er verre enn ibuprofen eller naproksen med hensyn til kardiovaskulær sikkerhet. Studien er følgelig gjennomført etter inferiority-design (5).
Forfatterne av studien konkluderer med at celekoksib i moderate doser ikke er verre enn (inferior to) ibuprofen eller naproksen med hensyn til kardiovaskulær sikkerhet. Blant resultatene det vises til er hasardratio (HR) for celekoksib versus naproksen på 0,93 (95 % konfidensintervall: 0,76-1,13), mens HR mellom celekoksib og ibuprofen var 0,85 (0,70-1,04) (5).
SCOT-studien: Celekoksib til pasienter uten kardiovaskulær risiko
I EU ble koksiber kontraindisert ved kardiovaskulær sykdom i 2005. Europeiske land er følgelig ikke representert i PRECISION-studien. I stedet har det blitt utført en studie der kardiovaskulær sikkerhet ble undersøkt hos pasienter over 60 år uten signifikant kardiovaskulær sykdom, SCOT-studien. I denne studien ble bruken undersøkt så nært opp til reell bruk som mulig, og legemidlene ble forskrevet fra egen lege etter randomisering. Ved behov justerte legen dosen innenfor godkjent doseområde. Både pasienten og legen var kjent med hvilket legemiddel hver enkelt pasient fikk, men utfall ble målt ved hjelp av medisinske registre og var blindet ved analyse (6).
I SCOT-studen ble totalt 7297 pasienter som sto på ikke-selektivt NSAID randomisert til enten å bytte til celekoksib eller å fortsette med det aktuelle NSAIDet. Pasientene ble fulgt opp i tre år. Også dette var en non-inferioritystudie finansiert av Pfizer, produsenten av Celebra/Celebrex (6).
Risikoen for kardiovaskulære hendelser under behandling (on-treatment analyse) var 0,95 per 100 pasientår for celekoksib mot 0,86 per 100 pasientår for ikke-selektive NSAIDs (HR 1,12, 95 % konfidensintervall: 0,81-1,22), noe som ikke viser statistisk signifikant inferiority for celekoksib (6).
Ingen konsensus om ekvipotente doser av NSAIDs
En av utfordringene ved tolkning av disse artiklene for klinisk praksis, er at det ikke foreligger konsensus med hensyn til ekvipotente doser av NSAIDs. En kilde fra 2006 oppgir sammenlignbare doser basert på godkjent doseområde og sammenlignbar dosering i kliniske studier. Lav døgndose oppgis å være 200 mg celekoksib, 1200 mg ibuprofen, 750 mg naproksen og 100 mg diklofenak. Middels til høy dose oppgis å være 400 mg celekoksib, 1800-3000 mg ibuprofen, 1000-1250 mg naproksen og 150-200 mg diklofenak daglig (10).
I PRECISION-studien var det av regulatoriske hensyn ikke anledning til å øke dosen av celekoksib utover 200 mg daglig for 90 % av pasientene. Gjennomsnittlig døgndose i studien var følgelig 209±37 mg celekoksib. Dosen av ibuprofen og naproksen kunne imidlertid økes til henholdsvis 2400 og 1000 mg daglig også for pasienter med osteoartritt. I studien var gjennomsnittlig døgndose 2045±246 mg ibuprofen og 852±103 mg naproksen, noe som tilsvarer tilnærmet 85 % av tillatt dose (5, 11). Det blir ikke presentert resultater fra PRECISION-studien som illustrerer risiko for kardiovaskulære hendelser justert for økende dose.
I SCOT-studien ble pasientene fulgt opp av egen lege og dosen ble justert ved behov basert på klinisk vurdering. Gjennomsnittlig døgndose av alle legemidlene var lav, henholdsvis 169,8±80,6 mg for celekoksib, 581,0±263,4 mg for naproksen, 675,9±345,9 mg for ibuprofen og 79,4±38,3 mg for diklofenak. Gjennomsnittlig døgndose er beregnet fra mengden som har blitt forskrevet fordelt på antall dager før behandlingen ble avsluttet (6). Lav gjennomsnittlig døgndose kan gjenspeile lav etterlevelse eller periodevis behandling hos en del av pasientene. Hvilken dose pasientene har fått forskrevet er ikke oppgitt.
Forfatterne av SCOT-studien oppgir at det i studieperioden ble publisert dokumentasjon på økt risiko for kardiovaskulære bivirkninger av diklofenak, noe som gjorde det nødvendig å tillate bytte fra diklofenak til alternativt ikke-selektivt NSAID i studieperioden (6).
På tross av at diklofenak har en COX-2-selektivitet på linje med celekoksib, ble diklofenak analysert som et ikke-selektivt NSAID i SCOT-studien (6). Ettersom diklofenak ved baseline sto for hele 39 % av brukerne, kan dette ha påvirket resultatet slik at en eventuell risikoøkning av celekoksib er underestimert. Selv om forfatterne oppgir signifikant non-inferiority ved analyse som inkluderer pasientene som droppet ut av studien (intention to treat, ITT-analyse) (6), er det etter vår vurdering ikke vist non-inferiority av bytte til celekoksib sammenlignet med å fortsette på ikke-selektivt NSAID i SCOT-studien.
Gjennomsnittlig behandlingseffekt på grensen til minste merkbare endring
Generelt regnes en reduksjon på VAS-skala på 9-12 mm som den minste endringen pasienten selv er i stand til å merke, selv om dette ikke nødvendigvis er klinisk relevant (12).
I PRESICION-studien ble det observert noe bedre effekt av naproksen sammenlignet med celekoksib og ibuprofen. Endring i VAS-score var -10,2±0,26 mm fra baseline for naproksen, -9,3±0,26 mm for celekoksib og -9,5±0,26 mm for ibuprofen. Selv om forskjellen var statistisk signifikant (p<0,001 for naproksen mot celekoksib, p=0,01 for naproksen mot ibuprofen), var endringen på VAS-skala for samtlige legemidler mindre enn -13,7, som er oppgitt å være grense for klinisk relevans (5).
I SCOT-studien ble bytte til celekoksib undersøkt hos pasienter som allerede ble behandlet med et ikke-selektivt NSAID eller diklofenak. Det ble observert høyere andel som ikke fullførte studien (drop-outs), hos pasientene som ble randomisert til å bytte til celekoksib sammenlignet med de som fortsatte på tidligere behandling, spesielt hos pasientene som byttet fra diklofenak (6). Dette kan tyde på at celekoksib ikke ga pasientene tilstrekkelig smertelindring, at forskrevet dose celekoksib var for lav til å gi tilstrekkelig effekt eller at bytte fra en behandling som pasienten opplever har god effekt kan gi redusert effektopplevelse av endret behandling.
Behandlingseffekt ble ikke undersøkt i SCOT-studien (6).
Svakheter knyttet til studiedesign i non-inferiority-studier
Både PRECISION-studien og SCOT-studien er gjennomført som non-inferiority-studier med formål å undersøke bivirkningsrisiko. Dette medfører at nullhypotesen som testes er at det ikke er forskjell mellom de to behandlingsalternativene som studeres. I effektivitetsstudier vil en undersøke om en behandling er vesentlig (signifikant) bedre enn en annen behandling eller placebo, og manglende data driver resultatet mot at det ikke er forskjell. I non-inferioritystudier vil manglende data fremdeles drive resultatet mot at det ikke er forskjell mellom de ulike behandlingsresultatene (11).
Både PRESICION-studien og SCOT-studien var preget av høy andel pasienter som ikke fullførte studien (drop-outs). I PRESICION-studien avsluttet 70 % av pasientene behandlingen før studien var fullført, mens 51 % av pasientene som byttet til celekoksib avsluttet behandlingen i SCOT-studien. Av pasientene som fortsatte på tidligere behandling med ikke-selektivt NSAID eller diklofenak avsluttet til sammenligning 30 % behandlingen i SCOT-studien (5, 6).
I begge studiene ble grensen for non-inferiority økt grunnet lav eventrate
Både PRECISION- og SCOT-studien var hendelsesdrevne, slik at det måtte oppstå et gitt antall kardiovaskulære hendelser før en kunne avslutte studien for å oppnå tilstrekkelig styrke (power) (5, 6).
I begge studiene ble det lagt til grunn at 2 % av pasientene ville få en alvorlig kardiovaskulær hendelse årlig (5, 6). I PRECISION-studien ble det observert en eventrate rundt 1 % for det primære endepunktet, noe som tyder på at de inkluderte pasientene hadde lavere kardiovaskulær risiko enn planlagt (8, 11). Samtidig gikk rekrutteringen til studien sakte og andelen pasienter som trakk seg fra studien var høyere enn forventet. På bakgrunn av dette ble protokollen endret fra 90 % til 80 % power, med non-inferioritygrense på 1,4 (5).
I SCOT-studien ble det observert 0,95 hendelser per 100 pasientår. Det er ikke overraskende at eventraten var lavere ettersom studien inkluderte pasienter med lav risiko for kardiovaskulære hendelser. Samtidig gikk rekrutteringen av pasienter til studien tregere enn forventet. På tross av at pasientene ble fulgt opp over lengre tid enn planlagt for å oppnå tilstrekkelig power endte studien med 87 % av planlagt mengde pasientår med eksponering. Det ble derfor besluttet å justere opp non-inferioritygrensen til 1,4 også i denne studien (6).
I begge studiene ble det utført protokollendring som ga 80 % power for non-inferiority. Dette defineres som mindre enn 40 % økning i kardiovaskulære hendelser (5, 6). Det vil si at øvre grense for 95 % konfidensintervall av HR for kardiovaskulære hendelser på celekoksib var mindre enn 1,4 sammenlignet med de øvrige behandlingsalternativene. I en kommentar til PRECISION-studien påpekes det at relativ risiko (RR) for alvorlige kardiovaskulære hendelser var 0,95 ved bruk av 200 mg celekoksib daglig, men økte til 1,29 og 2,96 ved henholdsvis 400 og 800 mg celekoksib daglig. Basert på dette er det svært usannsynlig at bruk av 200 mg celekoksib daglig ville vise seg å være inferior sammenlignet med ibuprofen og naproksen med en non-inferioritygrense på 1,4 (8).
Basert på design og resultater fra tidligere studier er det altså ikke overraskende at det ble funnet non-inferiority for celekoksib sammenlignet med naproksen, ibuprofen og diklofenak. På tross av eksponering av over 11 000 pasienter for celekoksib gir ikke studiene oss gode svar på kardiovaskulær risiko av celekoksib i sammenlignbare doser som ikke-selektive NSAIDs, og det er vanskelig å overføre resultatene til klinisk praksis. Nylig publiserte Cochrane-reviews av celekoksib mot revmatoid artritt og osteoartritt konkluderer med at det er usikkerhet knyttet til effekt og bivirkninger av celekoksib, blant annet fordi blant annet Pfizer ikke har gitt tilgang til datamaterialet fra de store studiene de har gjennomført for uavhengig vurdering (13, 14).
Det er også verdt å merke seg at både PRECISION og SCOT var myndighetspålagt oppfølging av viktige bivirkningssignaler (såkalte fase 4-studier). Likevel ble ikke resultatene publisert før etter at patentbeskyttelsen til celekoksib var utløpt.
KONKLUSJON
Generelt bør NSAIDs kun brukes ved sikker indikasjon og terskelen for å seponere bør være lav dersom pasienten ikke har god effekt eller opplever bivirkninger av behandlingen. Lavest mulig effektive dose bør brukes i kortest mulig tid, og kun til pasienter uten kardiovaskulær sykdom eller vesentlig risiko for dette.
Basert på tilgjengelig dokumentasjon mener vi det foreligger en doseavhengig risiko for kardiovaskulære bivirkninger av alle NSAIDs. Med hensyn til sammenlignbare doser synes naproksen å være forbundet med lavest risiko, men dette er ikke konsistent i alle studier. Selv om risikoøkningen for hver pasient synes å være relativt lav, vil den utstrakte bruken av NSAIDs likevel kunne medføre et betydelig antall alvorlige kardiovaskulære hendelser.
Nyere data tyder på at celekoksib i doser på 200 mg ikke medfører betydelig høyere risiko for kardiovaskulære bivirkninger sammenlignet med ibuprofen og naproksen i moderate til høye doser, men samtidig med noe dårligere behandlingseffekt. Hos pasienter med osteoartritt og revmatoid artritt har NSAIDs gjennomsnittlig en smertestillende effekt på nivå med minste endring pasienten selv er i stand til å merke, men lavere effekt enn det som regnes som grensen for klinisk relevans.
Ettersom både effekt og bivirkninger av NSAIDs er doseavhengige, ser vi ingen grunn til å anbefale et NSAID hvor lavdosebehandling tilsynelatende medfører samme risiko som høydosebehandling med andre NSAIDs.
Referenser
- Bhala N, Emberson J et al. Vascular and upper gastrointestinal effects of non-steroidal anti-inflammatory drugs: meta-analyses of individual participant data from randomised trials. Lancet 2013; 382(9894): 769-79.
- Bally M, Dendukuri N et al. Risk of acute myocardial infarction with NSAIDs in real world use: bayesian meta-analysis of individual patient data. BMJ 2017; 357: j1909.
- Angiolillo DJ, Weisman SM. Clinical pharmacology and cardiovascular safety of naproxen. Am J Cardiovasc Drugs 2017; 17(2): 97-107.
- Fanelli A, Ghisi D et al. Cardiovascular and cerebrovascular risk with nonsteroidal anti-inflammatory drugs and cyclooxygenase 2 inhibitors: latest evidence and clinical implications. Ther Adv Drug Saf 2017; 8(6): 173-182
- Nissen SE, Yeomans ND et al. Cardiovascular safety of celecoxib, naproxen, or ibuprofen for arthritis. N Engl J Med 2016; 375(26): 2519-29.
- MacDonald TM, Hawkey CJ et al. Randomized trial of switching from prescribed non-selective non-steroidal anti-inflammatory drugs to prescribed celecoxib: the Standard care vs. Celecoxib Outcome Trial (SCOT). Eur Heart J 2016. [Epub ahead of print].
- Gunter BR, Butler KA et al. Non-steroidal anti-inflammatory drug-induced cardiovascular adverse events: a meta-analysis. J Clin Pharm Ther 2017; 42(1): 27-38.
- FitzGerald GA. Imprecision: Limitations to Interpretation of a Large Randomized Clinical Trial. Circulation 2017; 135(2): 113-115.
- Solomon DH1. Selective cyclooxygenase 2 inhibitors and cardiovascular events. Arthritis Rheum 2005; 52(7): 1968-78.
- Chou R, McDonagh MS et al. Comparative Effectiveness Reviews, No. 38. Rockville (MD): Agency for Healthcare Research and Quality (US); 2011.
- Antman EM. Evaluating the cardiovascular safety of nonsteroidal anti-inflammatory drugs. Circulation 2017; 135(21): 2062-2072.
- Ehrich EW, Davies GM et al. Minimal perceptible clinical improvement with the Western Ontario and McMaster Universities osteoarthritis index questionnaire and global assessments in patients with osteoarthritis. J Rheumatol 2000; 27(11): 2635-41. [Abstract]
- Fidahic M, Jelicic Kadic A et al. Celecoxib for rheumatoid arthritis. Cochrane Database Syst Rev 2017; 6: CD012095.
- Puljak L, Marin A et al. Celecoxib for osteoarthritis. Cochrane Database Syst Rev 2017; 5: CD009865.
