Hvilke bivirkninger skal farmasøyter melde?
- Publicerad: 23.01.2012
Budskap
- Hovedformålet med spontanrapporteringssystemet er å identifisere nye, ukjente/ubeskrevne bivirkninger av legemidler så tidlig som mulig
- Farmasøyter oppfordres i tillegg til spesielt å være oppmerksomme på bivirkninger som skyldes feilbruk av reseptfrie legemidler og bivirkninger knyttet til naturmidler
- 1900 norske bivirkningsmeldinger ved likeverdig bytte har ikke gitt noen signaler om at dette medfører sikkerhetsproblemer
- Dialog med pasienten er viktigere for å trygge legemiddelbruken enn å melde kjente bivirkninger som oppstår i forbindelse med likeverdig bytte av preparat
- Ikke-alvorlige bivirkninger som er oppført i den godkjente preparatomtalen (SPC) trenger ikke å meldes, men pasienter som ønsker å melde kjente bivirkninger kan nå selv gjøre dette elektronisk
Bakgrunn
Siden 1. januar 2003 har bivirkningsmeldinger for legemidler fra helsepersonell blitt sendt til og håndtert av RELIS. Et viktig element i spontanrapporteringssystemet er kunnskap om hvordan det fungerer, hva formålet med systemet er. Hovedformålet med spontanrapporteringssystemet er å identifisere nye, ukjente/ubeskrevne bivirkninger av legemidler så tidlig som mulig. Leger og tannleger har meldeplikt etter Legemiddelforskriften, men farmasøyter er ikke omfattet av denne meldeplikten (1). Det har imidlertid aldri vært noen formelle hindringer for at autorisert helsepersonell kan melde bivirkninger (2). Fra 1. januar 2005 ble det av Statens legemiddelverk og RELIS satt i gang en landsdekkende informasjonskampanje for å stimulere til bivirkningsrapportering fra apotekarbeidende farmasøyter. Hensikten med ordningen var å styrke den nasjonale bivirkningsovervåkingen ved å øke rapporteringsfrekvensen av bivirkninger som Legemiddelverket fikk begrenset informasjon om: bivirkninger som oppstår ved likeverdig bytte, bruk av legemidler som selges uten resept og natur(lege)midler.
Likeverdig (generisk) bytte
I forkant av ny Apoteklov i 2001 ble det utarbeidet et nytt vedlegg til forskrift om rekvirering og utlevering av legemidler fra apotek: Generikalisten. Denne har senere blitt omdøpt til ”byttelisten” og oppdateres den første i hver måned på Statens legemiddelverks hjemmeside (3, 4). I 2003 ble hendelser/bivirkninger etter likeverdig bytte i følge byttelisten satt på overvåkingslisten. Bivirkningsmeldinger etter likeverdig bytte for 2005 (92% fra farmasøyter) ble evaluert og studien konkluderte med at det ikke fantes noen signaler som tydet på at likeverdig bytte medførte sikkerhetsproblemer. Dette betyr at man ikke lenger anser det som nødvendig å melde alle slike hendelser. RELIS og Legemiddelverket ønsker imidlertid fortsatt melding om alvorlige bivirkninger som oppstår ved likeverdig bytte (5), samt bivirkninger som ikke er beskrevet i den tilhørende godkjente norske preparatomtalen (SPC) (6).
Likeverdig bytte er en pågående debatt i flere fagmiljøer. Spesielt for antiepileptika er det skepsis mot å foreta likeverdig bytte, både blant behandlere og pasienter (7), men studier finner ikke grunnlag for at likeverdig bytte mellom antiepileptika gir redusert anfallskontroll eller økt forekomst av bivirkninger (8). Nesten alle problemer ved likeverdig bytte er knyttet til etterlevelse og ikke til selve legemidlene. Andre forklaringer kan være usikkerhet hos pasienten og/eller behandler på grunn av byttesituasjonen, placebo- og noceboeffekter og/eller et naturlig forløp av sykdommen. Pasienter har et stort behov for informasjon, også om bivirkninger, ved likeverdig bytte. Det som helsepersonell oppfatter som ufarlige bivirkninger kan ha stor innvirkning på pasientens hverdag og kan resultere i at pasienten på eget initiativ seponerer behandlingen. God dialog både før byttet og etter at pasienten har brukt legemidlet en stund er en viktig suksessfaktor (3, 5).
Reseptfrie legemidler og naturmidler?
Reseptfrie legemidler er i utgangspunktet vurdert som trygge legemidler, hvor bivirkningsbildet anses godt dokumentert, og hvor faren for uheldige hendelser som følge av feilbruk er liten. Likevel oppstår fra tid til annen reaksjoner som ikke tidligere er beskrevet og som kan være viktige for å definere risikogrupper eller presisere forsiktighetsregler for bruk av legemidlet. Eksempelvis førte mistanke om risiko for forsterkede allergireaksjoner på anestesimidler som følge av bruk av folkodin til at alt salg av hostemedisinen Tuxi ble stoppet i Norge i 2007 (9).
Under begrepet naturmidler kan man i denne sammenheng regne både de myndighetsgodkjente tradisjonelle plantebaserte legemidlene (TPL, tidligere naturlegemidler), men også ulike helsekost- og velværeprodukter som kan inneholde alt fra enkeltstående urter, til sinnrike kombinasjoner av vekster, kjemikalier og stoffer av animalsk opprinnelse. Kjennskapen til bivirkninger knyttet til produkter i den siste kategorien er selvsagt svært mangelfull, og selv om mange av disse produktene faller inn under Mattilsynets ansvarsområde, kan bivirkningsmeldinger også sendes RELIS, som i sin tur videreformidler informasjonen til relevant tilsynsmyndighet. Viktigheten av slike meldinger underbygges av at bransjen har et betydelig innslag av useriøse aktører, og at det stadig avdekkes helsefare knyttet til innhold av ulovlige stoffer (10). En økende omsetning av slike produkter også i apotek gjør det naturlig at farmasøyter også følger opp og melder bivirkninger av disse. I denne sammenheng er det også betimelig å minne om at farmasøyter har meldeplikt ved mistanke om bivirkninger av kosmetikk og kroppspleieprodukter (11). Kosmetikkbivirkninger skal meldes til folkehelseinstituttet (FHI) på eget meldeskjema som finnes på FHIs hjemmeside (12).
Farmasøytmeldinger
I studien fra 2005 av bivirkningsmeldinger etter likeverdig bytte var bare 55% av meldingene utfylt på en slik måte at de kunne evalueres (5). At så mange ikke kunne evalueres var trolig et resultat av at meldeordningen var ny for farmasøyter og fordi settingen i apotek ikke alltid gir nok opplysninger til å kunne vurdere årsakssammenheng. Norske farmasøyter har i klinisk setting vist at de er gode til å identifisere legemiddelbivirkninger og at vurderingene i stor grad samsvarer med legers (13). I en annen studie er det vist at bivirkningsmeldinger fra apotekfarmasøyter er et nyttig tilskudd til spontanrapporteringssystemet, men at kvaliteten på farmasøytmeldinger er noe lavere enn for legemeldinger. Dette skyldes hovedsakelig at farmasøytmeldinger gjelder mindre alvorlige bivirkninger og har færre klinisk relevante opplysninger (14). Kliniske farmasøyter har et spesielt godt utgangspunkt til å sørge for at bivirkninger meldes.
Hva meldes i dag?
Leger og tannlegers meldeplikt gjelder dødelige eller livstruende bivirkninger, bivirkninger som har gitt varige alvorlige følger og uventede eller nye bivirkninger (1). I tillegg til meldeplikten er det av stor interesse å få meldt bivirkninger som er knyttet til nye legemidler, legemidler som er under særlig overvåking (6), problemer ved seponering av legemidler samt reaksjoner på grunn av overdosering eller feilbruk av legemidler (inkludert de reseptfrie legemidlene). Det er viktig å være klar over at mistanke er nok for å melde, særlig når det gjelder nye og ukjente bivirkninger (2). En gjennomgang av bivirkningsmeldingene i første halvår 2011 viste at 10% av alle meldinger ble sendt inn fordi legemidlet står på overvåkingslisten. Erfaring viser også at 5-10% av nye legemidler trekkes fra markedet etter kortere eller lengre tid på grunn av bivirkninger eller usikker virkning (4, 15).
Figur 1 viser utviklingen når det gjelder bivirkningsmeldinger fra farmasøyter fra ordningen ble etablert i 2003 og frem til i dag. Som det fremgår av figuren var det de
første årene en voldsom overvekt av bivirkningsmeldinger knyttet til likeverdig bytte. Antallet slike meldinger har imidlertid avtatt år for år, i tråd med at likeverdig bytte ble tatt av overvåkingslisten, men utgjør i 2011 (tall per 19. desember) fortsatt 44% (75/170) av bivirkningsmeldingene fra farmasøyter. I helseregion Midt-Norge var andelen hele 71% (16). Om man ser bort fra meldingene knyttet til likeverdig bytte har meldefrekvensen imidlertid vært påfallende stabil på om lag 100 meldinger per år. På bakgrunn av de 45 millioner kundebesøk man har i norske apotek per år (17), er det nærliggende å tro at potensialet for å avdekke nye og ukjente bivirkninger er langt høyere.
Figur 1
Bivirkningsmeldinger fra farmasøyter i Norge 2003-2011
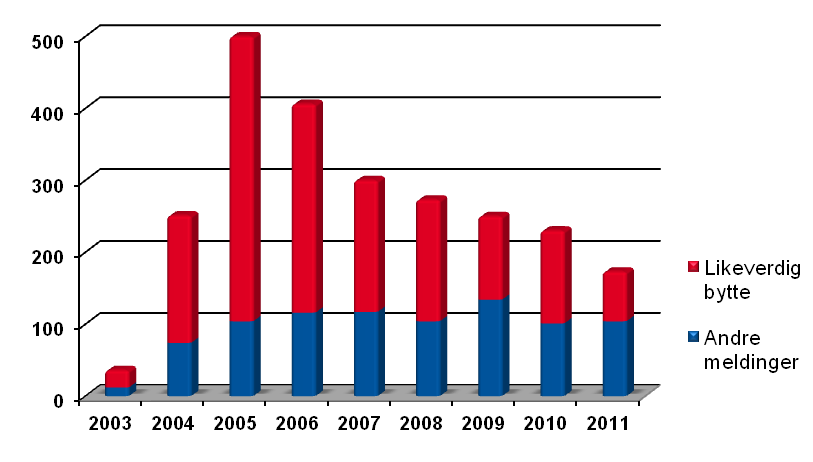
Antallet bivirkningsmeldinger fra farmasøyter i Norge fordelt mellom likeverdig bytte og andre bivirkningsmeldinger. Av bivirkningsmeldingene ved likeverdig bytte er 99% klassifisert som ikke-alvorlige. Data fra den norske bivirkningsdatabasen (16).
Hvilke bivirkninger skal meldes?
Selv om farmasøyter ikke har meldeplikt med hensyn på legemiddelbivirkninger oppfordres også farmasøyter til å melde bivirkninger som har gitt varige alvorlige følger, men fremfor alt oppfordres farmasøyter til å være oppmerksomme overfor nye, ubeskrevne bivirkninger av alle legemidler, og i særlig grad legemidler som er nye på markedet. Vi vet fra tidligere studier at bare halvparten av de bivirkningene man kjenner til etter at et preparat har vært på markedet i 10 år, var kjent på registreringstidspunktet (18). I tillegg oppfordres farmasøyter til spesielt å være oppmerksomme på bivirkninger som skyldes feilbruk av reseptfrie legemidler og bivirkninger knyttet til naturmidler og kosmetikk. Merk at kosmetikkbivirkninger skal meldes på eget skjema til Folkehelseinstituttet.
Hvilke bivirkninger trenger ikke meldes?
Ikke-alvorlige bivirkninger som er oppført i den godkjente preparatomtalen (SPC) skal ikke meldes av helsepersonell (6). Disse tilfører ikke bivirkningsdatabasen noen verdifull informasjon ettersom spontanrapporteringssystemet er et signalsystem og ikke kan brukes til å si noe om frekvens. At data fra spontanrapporteringssystemet ikke kan brukes til frekvensvurderinger skyldes først og fremst generell underrapportering. I størrelsesorden 1-10% av alle bivirkninger blir meldt, og selv for dødelige bivirkninger meldes maksimalt 30-50% (2).
Pasientmeldinger
Vanligvis vil pasienter ta opp sine (mistenkte) bivirkninger med helsepersonell: fastlegen, farmasøyten i apoteket eller en klinisk farmasøyt. Dersom disse vurderer at bivirkningen ikke er nødvendig å melde i henhold til avsnittene over, men pasienten likevel ønsker dette meldt har det fra 1. mars 2010 vært mulig for pasienter selv å melde bivirkninger til Legemiddelverket ved hjelp av elektronisk meldeskjema på Internett. Meldeskjemaet krever innlogging ved hjelp av en elektronisk ID (MinID, Commfides eller Buypass) via ID-porten. Dette sikrer at uvedkommende ikke får tilgang til personopplysninger (19). Dersom helsepersonell vurderer at bivirkningen bør meldes i henhold til avsnittene over er det en fordel at helsepersonellet melder bivirkningen. Dette for å sikre at flest mulig relevante opplysninger kommer med. Alle meldinger blir registrert, men pasientmeldinger og helsepersonellmeldinger behandles noe ulikt i Norge. Det blir ikke gitt tilbakemeldinger på pasientmeldinger og disse går direkte til Statens legemiddelverk, ikke innom RELIS. Både amerikanske og danske studier har vist at pasientmeldinger kan bidra til signaler om nye bivirkninger og at signaler oppdages tidligere (20, 21).
Konklusjon
Hovedformålet med spontanrapporteringssystemet er å identifisere nye, ukjente/ubeskrevne bivirkninger av legemidler så tidlig som mulig. I tillegg ønskes bevissthet omkring alvorlige bivirkninger som har betydelige konsekvenser for pasientene, slik at disse alltid bør meldes. Problemer ved seponering av legemidler samt reaksjoner på grunn av overdosering eller feilbruk av legemidler regnes også som bivirkninger. Ved likeverdig bytte er etterlevelse og usikkerhet hos pasient/behandler langt viktigere enn reelle forskjeller mellom preparatene. Bivirkninger kan da best forebygges gjennom god dialog både før byttet og etter at pasienten har brukt legemidlet en stund. Ikke-alvorlige bivirkninger som er oppført i den godkjente preparatomtalen (SPC) trenger heller ikke å meldes, men dersom pasienten likevel ønsker det kan dette gjøres elektronisk av pasienten selv.
Referenser
- Forskrift om legemidler (legemiddelforskriften). §10-6. http://www.lovdata.no/ (Sist endret: 5. februar 2010).
- Harg P, Lislevand H et al. Bivirkningsrapportering og legemiddelovervåking. Tidsskr Nor Lægeforen 2003; 123(3): 331-2.
- Madsen S, Nitteberg-Sørensen B et al. Byttelisten – et legemiddelpolitisk verktøy. Tidsskr Nor Legeforen 2008; 128(7): 837-9.
- Statens legemiddelverk. Overvåkingsliste. http://www.legemiddelverket.no/templates/InterPage____25810.aspx
- Reppe LA, Stenberg-Nilsen H et al. Bivirkninger ved generisk bytte i Norge i 2005. Tidsskr Nor Legeforen 2008; 128(23): 2696-700.
- Statens legemiddelverk. Preparatomtaler (SPC). http://www.legemiddelverket.no/legemiddelsok
- Berg MJ, Gross RA et al. Generic substitution in the treatment of epilepsy: patient and physician perceptions. Epilepsy Behav 2008; 13(4): 693-9.
- Kesselheim AS, Stedman MR et al. Seizure outcomes following the use of generic versus brand-name antiepileptic drugs: a systematic review and meta-analysis. Drugs 2010; 70(5): 605-21.
- Statens legemiddelverk, Salget av Tuxi hostemikstur stanses, http://www.legemiddelverket.no/templates/InterPage____36383.aspx (Publisert: 27. mars 2007).
- Statens legemiddelverk. Useriøse aktører og ulovlige stoffer i kosttilskudd, http://www.legemiddelverket.no/templates/InterPage____83321.aspx (Publisert: 5. desember 2011).
- Forskrift om meldeplikt for helsepersonell ved mistanke om bivirkninger av kosmetikk og kroppspleieprodukter (Sist endret: 14. mars 2008).
- Folkehelseinstituttet. Register for bivirkninger ved bruk av kosmetiske produkter. http://www.fhi.no/artikler/?id=69268 (Sist oppdatert 14. september 2010).
- Blix HS, Viktil KK et al. Characteristics of drug-related problems discussed by hospital pharmacists in multidisciplinary teams. Pharm World Sci 2006; 28(3): 152-8.
- Gedde-Dahl A, Harg P et al. Characteristics and quality of adverse drug reaction reports by pharmacists in Norway. Pharmacoepidemiol Drug Saf 2007; 16(9): 999-1005.
- Madsen S. Thalidomid 50 år etter – og Overvåkningslisten 10 år. Dagens medisin. http://www.dagensmedisin.no/blogg/ (Publisert: 16. desember 2011).
- Statens legemiddelverk. Den norske bivirkningsdatabasen, søk 19.desember 2011.
- Apotekforeningen. Apotek og legemidler 2011: 23.
- Eldholm RS, Bergheim TS et al. Hvilken informasjon gis om bivirkninger av nye legemidler? Tidsskr Nor Lægeforen 2003; 123: 2414-7
- Statens legemiddelverk. Bivirkningsmelding for pasienter. http://www.legemiddelverket.no/templates/InterPage____82265.aspx (Sist gjennomgått: 1. mars 2010).
- Hammond IW, Rich DS et al. Effect of consumer reporting on signal detection: using disproportionality analysis. Expert Opin Drug Saf 2007; 6(6): 705-12.
- Aagaard L, Nielsen LH et al. Consumer reporting of adverse drug reactions: a retrospective analysis of the Danish adverse drug reaction database from 2004 to 2006. Drug Saf 2009; 32(11): 1067-74.
