Paracetamol over «streken»?
- Publicerad: 12.12.2019
BUDSKAP
- Paracetamol er generelt et trygt og effektivt legemiddel så lenge det brukes i terapeutiske doser
- Paracetamol er levertoksisk først og fremst ved overdose, men ulike risikofaktorer kan medvirke til at terapeutiske doser kan bli toksiske hos enkelte pasienter
- Vær spesielt oppmerksom på risiko ved høye doser kort tid etter opphør av alkoholinntak hos pasienter med kjent kronisk alkoholforbruk, særlig i kombinasjon med andre risikofaktorer som underernæring
Paracetamol er et mye brukt legemiddel med antipyretiske- og analgetiske egenskaper, og er generelt ansett som trygt ved bruk i vanlige terapeutiske doser (inntil 4 gram per 24 timer hos voksne). Samtidig er det kjent at overdosering kan forårsake fatal eller nærfatal levercellenekrose. I USA er paracetamolintoksikasjon årsak til 50 % av de rapporterte tilfellene av akutt leversvikt samt omtrent 20 % av levertransplantasjonene (1, 2). Selv om det er veldokumentert at paracetamol først og fremst gir risiko for leverskade ved overdosering finnes det også flere kasusrapporter hvor paracetamol mistenkes å ha gitt toksisitet ved terapeutiske doser hos pasienter med risikofaktorer (3-7). Vi har sett nærmere på noen av disse risikofaktorene.
Legemiddelmetabolisme og eliminasjon
Levermetabolisme og renal ekskresjon er de dominerende eliminasjonsveiene for legemidler. Hepatisk eliminasjon er den viktigste eliminasjonsveien for lipidløselige legemidler, og omfatter i hovedsak to typer metabolisme: fase 1-metabolisme og fase 2-metabolisme.
Fase 1, kjemisk omdannelse hvor legemidlet enten oksideres, reduseres eller hydrolyseres, foregår ved hjelp av cytokrom P450-systemet. CYP-systemet er et av de viktigste enzymsystemene for legemiddelmetabolisme. CYP-enzymene er hovedsakelig lokalisert til levercellenes mikrosomer, og de katalyserer omdannelse av en rekke endogene og eksogene stoffer (3, 8). De mest aktive CYPene for metabolisme er subfamiliene CYP2C, CYP2D og CYP3A, hvor CYP3A4 medvirker i metabolismen av ~50 % av alle legemidler. Andre subfamilier, slik som CYP2E, er ikke særlig involvert i metabolismen av legemidler, men medvirker i metabolsk aktivering av mange protoksiner til reaktive metabolitter (3).
Fase 2 innebærer konjugering med et endogent molekyl som glukuronsyre, acetat, glutation eller sulfat for økt vannløselighet. De viktigste fase 2-enzymene er glutation-S-transferaser (GST), uridindifosfat- glukuronosyltransferaser (UGT) og sulfotransferaser (SULT). For paracetamol er konjugering med glutation, som katalyseres av GST, viktig for å fjerne toksisk metabolitt (se eget avsnitt om patofysiologi) (3, 8).
Kort om glutation
Glutation er et tripeptid som syntetiseres fra glutaminsyre, cystein og glycin. Glutation er enten i oksidert (GSSH) eller redusert form (GSH), og internt forhold mellom GSH/GSSH er essensielt for å opprettholde cellen i redusert tilstand, og med det, ha kapasitet til å forhindre oksidativ skade. Risiko for redusert detoksifiseringskapasitet foreligger ved lave nivåer av GSH (3, 5).
Patofysiologi ved paracetamolindusert levertoksisitet
Det er ikke modersubstansen paracetamol i seg selv som forårsaker leverskade, men en reaktiv metabolitt. Når inntaket av paracetamol er i tråd med generelle doseringsanbefalinger, blir 85-90 % metabolisert direkte via fase 2-metabolisme ved konjugering med glukuronsyre eller sulfat og deretter eliminert renalt eller via galle (se figur 1). En liten andel gjennomgår fase 1-metabolisme ved oksidasjon via CYP-systemet, hovedsakelig CYP2E1 og CYP2A6. Isoenzymene CYP3A4 og CYP1A2 deltar også, men i svært liten grad. Via CYP2E1 dannes den svært reaktive oksidative metabolitten N-acetyl-p-benzokuinon imin (NAPQI), som kan gi hepatocellulær skade grunnet særlig affinitet til cysteinmolekyler på proteiner i leveren (3, 5).
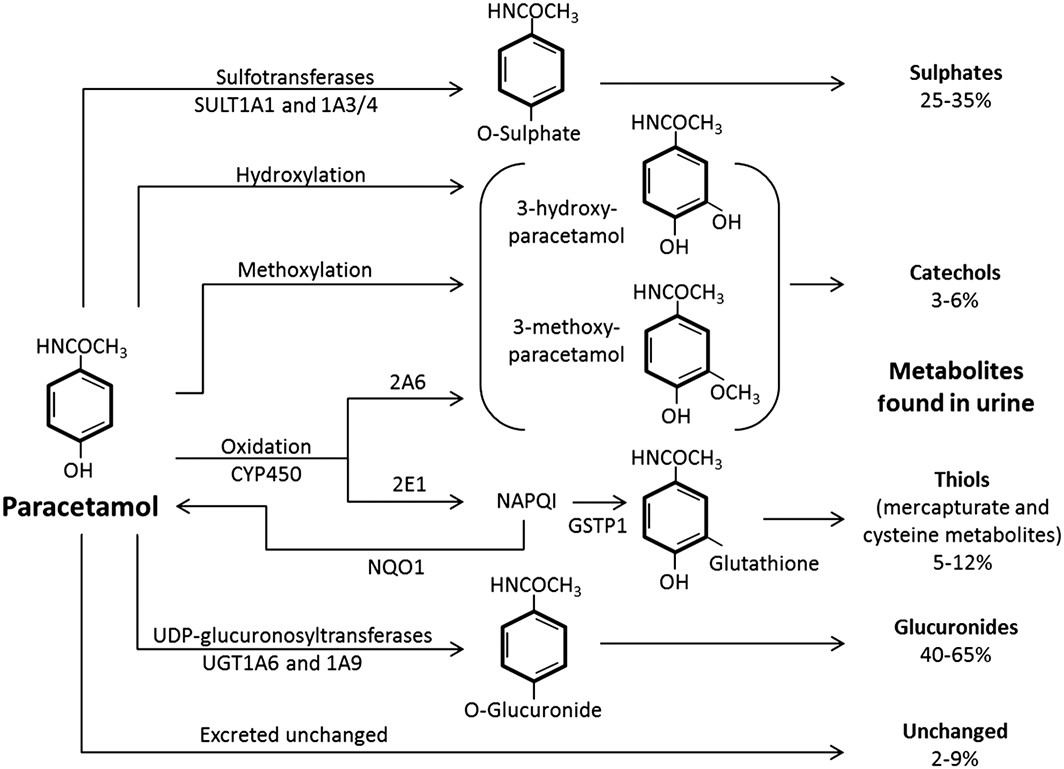 Figur 1 viser metabolismen av paracetamol (gjenbrukt med tillatelse fra Hayward et al (ref 4).
Figur 1 viser metabolismen av paracetamol (gjenbrukt med tillatelse fra Hayward et al (ref 4).
Under de fleste omstendigheter er en frisk lever i stand til å detoksifisere NAPQI via konjugering med endogent glutation katalysert av GST (2, 4, 8). Ved overdose med paracetamol kan derimot de endogene lagrene av glutation brukes opp. Når paracetamoldosen blir høy nok vil normal metabolismevei via konjugering med glukuronsyre og særlig med sulfat kunne mettes. Mer paracetamol vil metaboliseres via CYP2E1 med påfølgende økt dannelse av den toksiske metabolitten NAPQI. Mengden NAPQI kan da overskride cellens kapasitet for detoksifisering (jfr. tomme glutationlagre). NAPQI, som er sterkt elektrofilt, binder seg så til cysteingrupper på makromolekyler, særlig på mitokondrier og skader cellen. Etter hvert som reaksjonen eskalerer progredierer hepatocellulær celleskade og fulminant leversvikt kan oppstå (1, 2, 4).
Risikofaktorer for toksisitet
Foruten klar kausalitet med for høyt inntak av paracetamol (overdose), er det en del andre forhold som kan gjøre pasienter mer sårbare for leverskade sekundært til inntak av paracetamol. Oppslagsverket UpToDate nevner i den sammenheng redusert kapasitet for konjugering med glukuronsyre og sulfat, økt aktivitet i CYP-systemet, samt reduserte lager av glutation. En mengde faktorer kan medvirke til å forrykke balansen i metabolismen, herunder alkoholinntak, bruk av enkelte andre legemidler, sammenfallende sykdom, høy alder, genetisk disposisjon og ernæringsstatus (1). Hayward og medarbeidere viser til at brorparten av kasusrapportene hvor terapeutiske doser av paracetamol i normalområdet har utløst toksisitet, er hos pasienter med en eller flere av disse risikofaktorene (1, 4, 6).
Alkoholstatus – trolig størst risiko kot tid etter opphold i inntak?
Hepatotoksisitet er rapportert ved bruk av terapeutiske doser av paracetamol hos pasienter med langvarig høyt alkoholforbruk. Uavhengig av BMI er det ikke uvanlig at alkoholavhengige er feilernærte, noe som kan påvirke nivået av glutation. Interessant nok er etanol også en induktor av CYP2E1, enzymet som danner den toksiske metabolitten NAPQI. Et langvarig høyt alkoholforbruk vil således potensielt både kunne føre til økt dannelse av toksisk metabolitt, samt gi dårligere detoksifiseringskapasitet. På den andre siden er det også vist at etanol er et kompetitivt substrat for CYP2E1, samt en induktor av NQO1 (som reverserer dannelsen av NAPQI). Dette vil være mekanismer som kan motvirke de førstnevnte leverskadelige mekanismene, og nettoeffekten blir vanskelig å forutsi (4).
Klinisk relevans
Da etanols enzyminduksjon vedvarer i 3-8 dager etter avsluttet inntak (økt dannelse av NAPQI), er trolig sårbarheten risiko hos pasienter med kronisk høyt alkoholforbruk økt i cirka en uke etter avsluttet alkoholinntak. Klinisk relevans vil nok likevel være størst hos pasienter som også har andre risikofaktorer. Større randomiserte studier har ikke funnet økt risiko for paracetamolindusert leverskade hos stordrikkere uten andre risikofaktorer ved kortvarig behandling. Forfatterne av en oversiktsartikkel antar med bakgrunn i dette at normaldose paracetamol (inntil 3-4 gram over en kort periode) er relativt trygt for denne pasientgruppen, så lenge det ikke foreligger andre risikofaktorer som dekompensert cirrhose, under- og feilernæring (4).
Kasuistikkeksempel
Hayward og medarbeidere viser til flere kasuistikker hvor normale doser har blitt problematisk. Følgende eksempel er illustrerende. En 32 år gammel kvinne ble innlagt med akutt alkoholabstinens og magesmerter sekundært til alkoholisk gastroenteritt. Hun fikk behandling med vitamintilskudd, et benzodiazepin, samt oral paracetamol 4 gram per døgn. Pasienten veide 44 kg ved innleggelse. Ultralyd av abdomen samt ASAT (56 U/L) var upåfallende. Tre dager senere ble pasienten agitert og klagde over kvalme. Det ble påvist akutt leversvikt med ASAT 7116 U/L og INR 3,2. Serumkonsentrasjon av paracetamol var forhøyet (105 mg/L). Pasienten fikk behandling med acetylcystein, og etter 15 dager kunne hun skrives ut med normale leverprøver (4, 6-7).
Forfatterne viser til at akutt inntak av doser på 150 mg/kg/døgn kan forårsake alvorlig hepatocellulær nekrose. I aktuelt kasus fikk pasienten 91 mg/kg/døgn over flere dager, noe de påpeker kan være problematisk og gi leverskade og akutt leversvikt hos pasienter med nedsatt metabolsk kapasitet og risikofaktorer. De konkluderer med at hos pasienter som innlegges bør man være oppmerksom risikofaktorer samt dosering opp mot kroppsvekt (6). Norsk Legehåndbok (NEL) viser i tillegg til hva som anses å være toksisk dose ved akutt, subakutt og kroniske inntak. Ved inntak av paracetamol som strekker seg over 48 timer kan toksisitet oppstå ved doser på 100 mg/kg/døgn eller mer. Hos risikogrupper, selv om dette er omdiskutert, antas det at doser over 75 mg/kg/døgn kan gi toksisitet ved subakutt og kronisk inntak over flere dager (7).
Interaksjoner
Samtidig bruk av legemidler eller andre agens som induserer CYP2E1 kan disponere for paracetamolindusert levertoksisitet, også ved doser som i utgangspunktet ikke forventes å være toksiske. Blant legemidler som er kjent for å indusere CYP2E1 er antiepileptika som karbamazepin, fenobarbital og fenytoin, og tuberkulosemidler som isoniazid og rifampin. Enkelte naturmidler som for eksempel johannesurt kan også indusere CYP2E1 (1).
Legemidler som trimetoprim-sulfa, opioider (OBS: faste kombinasjoner med paracetamol) og zidovudin kan også gi økt risiko for paracetamolindusert levertoksisitet gjennom å konkurrere om kapasiteten via metabolismeveier som involverer glukuronidering. Samtidig bruk av disse vil kunne føre til økt paracetamolmetabolisme via CYP2E1, og dermed mer dannelse av toksisk metabolitt (1, 4, 7)
Ernæringsstaus og alder
Hepatisk konjugering med glukuronsyre er avhengig av hepatiske karbohydratlagre. Ved faste, under- eller feilernæring kan konjugeringskapasiteten være redusert, noe som kan øke dannelsen av NAPQI. Ved kompromitterte glutationlagre er slike pasienter disponert for hepatisk skade (1, 7).
Bivirkningsmeldinger
RELIS og klinisk farmakologi har mottatt enkelte rapporter og besvart henvendelser om raskt innsettende toksisitet ved presumptivt «trygge» doser < 4 gram per døgn. Dette hos pasienter hvor en kan mistenke at alkoholbruk og redusert ernæringsstatus har disponert pasienten for toksisitet etter innleggelse. Uavklart paracetamolbruk før innleggelse kan også ha vært medvirkende. Serumkonsentrasjonen av paracatamol er ikke nødvendigvis uttalt forhøyet hos disse pasientene. Et annet moment som kan bidra til forsinket behandling med acetylcystein, er at paracetamolforgiftning ikke gir endret bevissthet hos pasienten tidlig i forløpet mens spesifikk behandling fremdeles kan forhindre leverskade. Dermed kan andre symptomer/tegn som kvalme og magesmerter bli tilskrevet andre årsaker (7).
OPPSUMMERING
Paracetamoltoksisitet er et kjent klinisk problem, som klart oftest er knyttet til overdoser/overdosering. Oppmerksomhet rundt at også «standarddosering» potensielt kan utløse toksisitet hos sårbare pasienter er trolig varierende. Pasienter med risikofaktorer, som høyt alkoholforbruk og underernæring, krever individuell vurdering. Behandlere bør etter vårt syn være varsom med liberal forskrivning av doser på 4 gram per døgn som standard. Man bør også ha et bevisst forhold til dosering ved behov hos slike pasienter. Pasienter skal ikke uforvarende overdoseres i terapeutisk hensikt, kanskje til og på uklar indikasjon, med et av de mer leverskadelige medikamenter vi har.
Referenser
- Burns MJ, Friedman S et al. Acetaminophen (paracetamol) poisoning in adults: Pathophysiology, presentation, and diagnosis. Version 36.0. In: UpToDate. https://www.helsebiblioteket.no/ (Sist oppdatert: 11. april 2019)
- Lancaster EM, Hiatt JR et al. Acetaminophen hepatotoxicity: an updated review. Arch Toxicol 2015; 89(2): 193-9.
- Brunton LL, editor. Goodman and Gilman`s. The parhmacological basis of therapeutics 2006; 11th ed. (71-93).
- Hayward KL, Powell EE et al. Can paracetamol (acetaminophen) be administered to patients with liver impairment? Br J Clin Pharmacol 2016 ;81(2):2 10-22.
- LiverTox database. (Søk: 18. september 2019).
- Claridge LC, Eksteen B et al. Acute liver failure after administration of paracetamol at the maximum recommended daily dose in adults. BMJ 2010; 341: c6764.
- Norsk elektronisk legehåndbok. Paracetamolforgiftning. https://legehandboka.no/ (Sist endret: 2. juli 2018).
- Norsk legemiddelhåndbok for helsepersonell. Farmakokinetikk og doseringsprinsipper. http://legemiddelhandboka.no/ (Sist oppdatert: 27. mai 2015).
Forfattere
