Mer om problematiske protonpumpehemmere
- Publicerad: 10.11.2020
Les kronikken i Tidsskrift for Den norske legeforening: Raknes G, Giverhaug T. Problematiske protonpumpehemmere. Tidsskr Nor Legeforen 2020; 140 (16): 1624-6.
Den første protonpumpehemmeren (PPI), omeprazol, ble patentert av Astra AB i 1978 og godkjent for medisinsk bruk i 1988. Under merkenavnet Losec ble omeprazol et av de mest lønnsomme produktene i svensk industrihistorie. Omsetningen av Losec toppet seg i 2001 med 6,1 milliarder dollar, noe som overgikk hele eksportverdien av Volvo-konsernet. For å kompensere for at patentet for omeprazol utløp i 2002, fikk Astra patentert s-enantiomeren (s-omeprazol; esomeprazol) som under merkenavnet Nexium sikret fortsatt god fortjeneste i mange år. Nå er de fleste PPIer tilgjengelige som generiske preparater, og selv om forbruket er økende, er protonpumpehemmerne ikke lenger blant de mest lønnsomme legemidlene på markedet.
Farmakologi
PPI hemmer magesyreproduksjonen nesten helt fullstendig ved irreversibel binding til hydrogen/kalium ATPasen (protonpumpen) i ventrikkelens parietalceller. Da PPIene kom på markedet, revolusjonerte de behandlingen av magesyrerelaterte tilstander og utkonkurrerte raskt histamin 2-reseptorantagonistene (H2RA). I Norge markedsføres fire ulike PPI. Omeprazol, pantoprazol, lansoprazol og esomeprazol er nærmest identiske når det gjelder virkningsmekanisme og klinisk effekt, men med enkelte farmakokinetiske forskjeller. For eksempel er omeprazol en moderat hemmer av CYP2C19, noe som kan påvirke effekten av antiepileptikumet fenytoin og platehemmeren klopidogrel. I teorien kan også endret surhet i magesekken påvirke biotilgjengeligheten av visse andre legemidler.
Indikasjoner og refusjon
Brukt riktig kan PPI være livreddende behandling. Ved Barretts øsofagus, alvorlig øsofagitt, påvist blødende magesår og ved kontinuerlig bruk av NSAIDs er den kliniske nytten av langvarig PPI-bruk veldokumentert. PPI brukes imidlertid mer eller mindre rutinemessig også i andre sammenhenger; for eksempel under og etter operasjoner/intensivbehandling. Det synes også å være en etablert praksis å forskrive PPI etter gjennomgått hjerteinfarkt i perioden hvor pasienten også bruker dobbel platehemming (1). Rutinemessig bruk av PPI under prednisolonkur er mer omdiskutert (2). Når det gjelder forebygging av sår relatert til annen legemiddelbruk er indikasjonsområdet klart; bare forebygging av NSAIDs-relaterte GI-sår er nevnt. Under de spesifikke refusjonskodene (ICPC, ICD) brukes formuleringen “forebygging av legemiddelrelaterte mage- og duodenalsår hos risikopasienter”, men det er presisert at refusjonsberettiget bruk er «behandling og forebygging av NSAID-relaterte mage- og duodenalsår hos risikopasienter med behov for langtidsbehandling med NSAID». Statens legemiddelverk kan ikke sikkert slå fast at acetylsalisylsyre (lavdosert, som platehemmer) er å anse som et NSAID i denne sammenheng (pers. medd). Bare (entero)tabletter av PPI i lave styrker er godkjent og refusjonsberettiget som profylakse/vedlikeholdsbehandling.
Farmakoepidemiologi
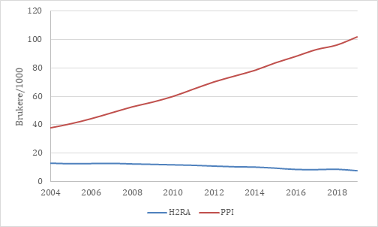
Figur 1: Andel brukere av histamin-2-reseptorantagonister (H2RA) og protonpumpehemmere (PPI, proton pump inhibitor) i befolkningen i perioden 2004–19 (data fra Reseptregisteret) (1). Reseptfrie midler og kombinasjonspreparatet Vimovo (naproksen og esomeprazol) er ikke medregnet.
Fra Reseptregisterets oppstart i 2004 til de siste oppdaterte tall i 2019 har økningen i antallet brukere av protonpumpehemmere vært konstant og uten tegn til avflatning (Figur 1). I 2019 hentet mer enn 10 % av befolkningen (544 000 personer) minst en resept på PPI, for personer over 75 år gjaldt dette mer enn hver fjerde innbygger (Figur 2). For pasienter over 75 år, er det gjennomsnittlige antall utleverte doser PPI per år fire ganger større enn for resten av befolkningen, noe som tyder på at langvarig bruk og høye doser er mye mer vanlig blant de eldste (Figur 3). I tillegg til forbruket som registreres i Reseptregisteret, kommer bruk av reseptfritt PPI.
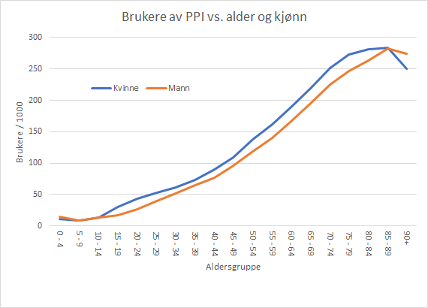
Figur 2: Andel brukere av PPI etter alder og kjønn
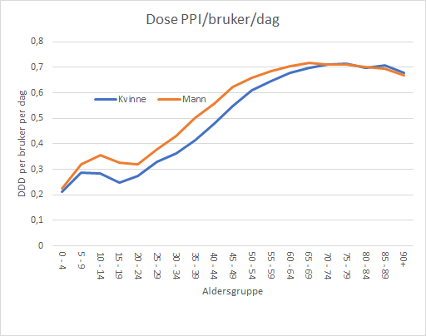
Figur 3: Forbruk av PPI i definerte døgndoser per bruker per dag i ulike aldersgrupper og kjønn
Er PPI avhengighetsskapende?
Endret forekomst av magesyrerelaterte tilstander i befolkningen kan ikke forklare at forbruket av PPI har økt med 330 % (i definerte døgndoser, DDD per innbygger) fra 2004 til 2019. Til sammenligning har tallet på brukere av H2RA gått ned med 20 % i samme periode. Vi mener det er grunn til å tro at økningen i PPI-bruk skyldes at PPI stadig oftere brukes uten sikker indikasjon, og fordi pasienter som burde seponert PPI etter kort tid ikke klarer å avslutte behandlingen.
Studier fra andre land underbygger denne antagelsen. Blant innlagte pasienter som brukte PPI i USA og Australia hadde 40 – 65 % manglende dokumentert indikasjon for bruk, tilsvarende tall for pasienter i allmennpraksis i USA og Storbritannia var 40 % – 55 % (3). Danske og islandske reseptregisterstudier (4,5) viser at insidensen av nyforskrivning er konstant, mens prevalensen av PPI-bruk øker (som i Norge). Dette taler for at det er vanskeligheter med seponering mer enn økt forekomst av tilstander som krever PPI som ligger til grunn for det økte forbruket.
Rebound/avhengighet
PPI blokkerer irreversibelt protonpumper i parietalcellene slik at syreproduksjonen reduseres med 99 % etter noen dagers sammenhengende bruk. Stigende pH i magesekken stimulerer produksjonen av gastrin som i sin tur gir vekst av histaminproduserende enterokromafinlignende celler, slik at kapasiteten for sekresjon av magesyre øker. Når PPI så reduseres eller seponeres etter flere ukers bruk (Figur 4), blir resultatet en kraftig økning i produksjonen av magesyre sammenlignet med før behandlingsstart. Dette vil ofte gi ubehagelige symptomer fra magesekk og spiserør. Også blant friske frivillige uten gastritt eller øsofagitt vil slike plager kunne oppstå. På denne måten er det fare for at pasientene starter opp igjen og blir stående på PPI-behandling selv om enkelte av dem i utgangspunktet ikke hadde indikasjon for behandlingen. Ved seponeringsforsøk blir ubehaget så sterkt at både lege og pasient oppfatter at PPI er nødvendig.
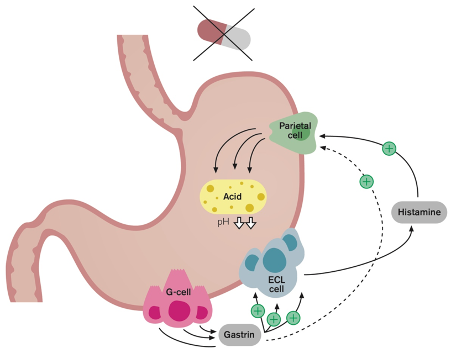
Figur 4: Etter seponering av PPI kan magesyresekresjonen øke til nivåer som er høyere enn før behandlingen startet. Hypergastrinemi sekundært til PPI-behandling er assosiert med hypersekresjon av saltsyre, såkalt «rebound acid hypersecretion». ECL: Enterokromafinlignende celle (fra Helgadottir et al () Creative Commons Attribution (CC BY) license (http://creativecommons.org/licenses/by/4.0/).
Negative konsekvenser av langtidsbruk
De fleste pasienter opplever lite bivirkninger under bruk av PPI, men stadig flere studier tyder på at langtidsbruk likevel kan ha flere uheldige effekter. Den omfattende bruken av PPI hos pasienter med ulike tilstander har resultert i et stort antall observasjonsstudier. Likevel er det utfordrende å trekke sikre konklusjoner fordi utfallsmålene ofte kan være knyttet til pasientenes underliggende sykdom eller bruk av andre legemidler. PPI-bruk er på sett og vis en indikator for generell sykelighet og polyfarmasi. Selv metaanalyser gir motstridende resultater. I de fleste randomiserte studier er varighet av eksponering og observasjon kort, og ofte med selekterte studiedeltakere som ikke nødvendigvis er representative for typiske langtidsbrukere av PPI.
Malabsorpsjon
Magnesium
Mye taler for at langvarig økt pH i magesekken er uheldig for opptaket av vitaminer og mineraler.
PPI hemmer opptaket av magnesium både ved endret pH, og ved å hemme aktivt opptak i tykktarm mediert av H+/K+ ATPase. Et anslag tyder på at 1 % av de innrapporterte bivirkningene på PPI kan knyttes til hypomagnesemi. Risikoen er særlig stor ved samtidig bruk av slyngediuretika (6).
Kliniske manifestasjoner av magnesiummangel er blant annet hjertearytmier, hemodynamisk instabilitet og kramper, og ofte har pasientene også lave nivåer av kalium og kalsium som bidrar til de samme symptomene.
Gjennomsnittlig tid til debut av PPI-indusert hypomagnesemi var 5,5 år, men med en variasjon fra 2 uker til 13 år. Alle PPI, også i lave doser ser ut til å redusere opptaket av magnesium. Etter seponering normaliseres magnesiumnivået i løpet av få dager. H2RA påvirker magnesiumnivået i langt mindre grad (6).
Kalsium/osteoporose
pH i magesekk og duodenum er viktig for opptaket av kalsium. For eksempel er 96 % av kalsiumkarbonat oppløst ved pH 1, men bare 23% ved pH 6. PPI vil i tillegg til å øke pH kunne påvirke kalsiumomsetningen indirekte gjennom hypomagnesemi, siden magnesium er en essensiell kofaktor for frigjøring av paratyreoideahormon ved hypokalsemi. PPI kan dessuten hemme en H+/K+ ATPase som er involvert i osteoklasters remodellering av benvev.
Det er ikke endelig avklart hvilken betydning dette har for risikoen for osteoporose. Bildet kompliseres av at mange pasienter har flere risikofaktorer. Legemiddelmyndigheter og relevante fagmiljøer har vinglet i sine anbefalinger om PPI og osteoporose. En metaanalyse fra 2019 viste at sammenlignet med ikke-brukere, hadde pasienter som brukte PPI økt risiko for osteoporose (HR 1,2), hoftebrudd (HR 1,3), brudd i ryggsøyle (HR 1,5) og brudd generelt (HR 1,3) (7).
Vitamin B12, jern, sink
Opptak av vitamin B12, jern og sink påvirkes av pH i magesekk og duodenum. Produksjon av intrinsic factor fra parietalceller er viktig for normalt opptak av vitamin B12. Langvarig bruk av PPI kan gi atrofisk gastritt og forstyrret parietalcellefunksjon. PPI kan bidra til endret stabilitet av askorbinsyre og dermed redusert opptak av ikke-hembundet jern. Kronisk PPI-bruk bør vurderes som årsak ved mangel på jern, sink eller vitamin B12 (8).
Infeksjoner
En av de viktigste funksjonene til det sure miljøet i magesekken, er å hindre at uønskede bakterier og parasitter inntar tarmen. I tillegg er det antatt at magesekken utgjør en retrograd barriere som forhindrer at bakterier fra tarmen når luftveiene. Selv kortvarig bruk av PPI kan gi endringer i tarmens mikrobiom på grunn av økt pH i magesekken og i den øverste delen av tynntarmen. Det er vist at bruk av PPI er assosiert med økt risiko for bakteriell overvekst i tynntarm og kolonisering med multiresistente bakterier. Økt forekomst av tarmbakterier i spiserøret etter oppstart med PPI er også sett. Mye taler for at det er en sammenheng mellom bruk av PPI og økt risiko for Clostridioides difficile-infeksjon (RR 1,3), også for pasienter som ikke bruker antibiotika. Risikoen er større for PPI enn for H2RA (9). Men for eldre pasienter som har utviklet C. Difficile-infeksjon, kan PPI muligens redusere dødeligheten (10).
Flere observasjonsstudier har vist en sammenheng mellom PPI-bruk og pneumoni, men fordi underliggende tilstander som reflukssykdom også øker risikoen er det en viss usikkerhet rundt den faktiske årsakssammenhengen.
Kreft?
Gastrin er en generell vekstfaktor for celler i fordøyelseskanalen, og det er holdepunkter for at høye konsentrasjoner av gastrin er assosiert med blant annet kreft i magesekk, pankreas og tykk/endetarm. Fremdeles er det kontroversielt hvor klinisk relevant dette er. Et forskningsmiljø ved St. Olavs Hospital har over mange år advart mot magekreft på grunn av langvarig bruk av PPI. De peker på studier som viser at hypergastrinemi er assosiert med magekreft (gastric cancer) både hos dyr og mennesker, og at PPI er den eneste legemiddelgruppen som fører til langvarig hypergastrinemi ved anbefalte doser i vanlig klinisk praksis. Det er også holdepunkter for at PPI kan forsterke karsinogene effekter av Helicobacter pylori, og det er avgjørende at en eventuell infeksjon saneres før oppstart med PPI. Ved reflukssykdom mener de norske forskerne at PPI bør reserveres til de mest alvorlige tilfellene, og H2RA bør forsøkes først fordi PPI-behandling fører til toleranse for H2RA. Særlig hos yngre pasienter bør PPI unngås på grunn av lang latenstid for kreftutvikling (11).
For pasienter med Barretts øsofagus, er bruk av PPI et viktig tiltak for å forhindre kreftutvikling, det samme gjelder PPI som en del av behandling mot H. pylori som er assosiert med enkelte kreftformer. Assosiasjoner mellom PPI og kreft er i all hovedsak basert på observasjonsstudier med til dels motstridende resultater.
Magesekk
I en metaanalyse fra 2016 fant forskerne at langvarig bruk av PPI var assosiert med økt forekomst av polypper i magesekken (fundic gland polyps). På grunn av stor heterogenitet mellom de inkluderte studiene ga ulike analysemetoder ulike risikoanslag fra OR 1,4 (95% KI 1,2-1,6) til OR 2,5 (1,2-4,8) ( 12). Når det gjelder magekreft, viste en metanalyse fra 2019 som omfattet nærmere en million pasienter at langvarig bruk av PPI var assosiert med en mer enn dobling av risikoen (OR 2,1, 95% KI 1,1-3,1) (13).
I en britisk registerbasert kasuskontrollstudie som undersøkte både PPI og H2RA samlet, fant forfatterne en sammenheng med magekreft dersom man brukte en 1-års periode for å identifisere ikke-bruk av PPI/H2RA (lag) (OR 1,5, 95% KI 1,2-1,8). Dersom lag økte til 2 år var ikke syrehemmerne signifikant assosiert med økt risiko (OR 1,1, 95% KI 0,9-1,4) (14).
For sammenligninger mellom H2RA og PPI, eller mellom ulike PPIer, er kunnskapsgrunnlaget langt mindre. I en registerstudie basert på amerikanske krigsveteraner, fant forskerne en høyere dødelighet av kreft i øvre del av fordøyelseskanalen blant langtidsbrukere av PPI sammenlignet med langtidsbrukere av H2RA (HR 1,8, 95% KI 1,2-3,0) (15).
På den andre siden kan det ikke utelukkes at den økte forekomsten av magekreft også kan skyldes grunnsykdom, komorbiditet eller indirekte effekter av PPI. Vitamin B12-mangel kan være en forklaring (16).
Pankreas
En metaanalyse fra 2020 som inkluderte mer enn 70.000 tilfeller av pankreaskreft og mer enn 600.000 kontroller viste at bruk av PPI ga en betydelig økt forekomst av denne alvorlige kreftformen (OR 1,75). Den økte risikoen var uavhengig av behandlingsvarighet og kumulativ dose PPI (17).
I en svensk registerstudie som inkluderte 796492 langtidsbrukere av PPI og 20210 langtidsbrukere av H2RA fant forskerne en mer enn dobling (SIR 2,12 95% CI 2.12–2.32) av risiko for pankreaskreft ved bruk av PPI etter justering for behandlingsindikasjon, alder, kjønn og varighet av behandlingen. Den relative risikoøkningen var størst for pasienter under 40 år (SIR 8,90 95% CI 4.26–16.37) og for pasienter med gjennomgått H.pylori-infeksjon (SIR = 2.99, 95% CI 2.54–3.49). For H2RA var det ingen økt risiko for pankreaskreft (18).
Hjerte-kar
Teoretisk er det grunnlag for at PPI kan ha uheldige effekter på hjerte/karsystemet. PPI-relatert hypomagnesemi kan som nevnt over bidra til arytmier, og vitamin B12-mangel på grunn av PPI kan tenkes å bidra til annen hjertesykdom. Omeprazol kan gjennom hemming av CYP2C19 gi redusert blodplatehemmende effekt av klopidogrel (redusert omdanning til aktiv metabolitt). Pantoprazol anbefales derfor til disse pasientene. Det er også holdepunkter for at PPI kan bidra til økt oksidativt stress og raskere aldring av endotel. Pasienter med etablert hjertesykdom bruker oftere PPI enn andre, blant annet for å unngå blødninger i mageslimhinnen på grunn av blodfortynnende midler (19).
En overvekt av metaanalyser viser økt risiko for kardio- og cerebrovaskulær sykdom ved bruk av PPI, men ikke H2RA. Mesteparten av kunnskapsgrunnlaget er basert på observasjonsstudier, og det finnes enkelte randomiserte studier som ikke viser økt kardiovaskulær dødelighet. På den annen side har slike prospektive studier ofte svært strenge inklusjonskriterier og er av begrenset varighet. Et annet moment er at nytten av den mageslimhinnebeskyttende effekten langt kan overgå risikoen for hjertesykdom. For eksempel viste en studie blant hjertefriske en betydelig økt relativ risiko for hjerteinfarkt av langtidsbruk av PPI (justert HR 1,58, 95% KI 1,11-2,25) i en 120-dagers oppfølgingsperiode. Den absolutte risikoøkningen var likevel lav, og hele 4357 pasienter måtte behandles med PPI for å gi et ekstra tilfelle av hjerteinfarkt (20).
Demens
PPI har flere effekter som i teorien kan bidra til økt risiko for demens. For eksempel kan redusert opptak av vitamin B12 og andre vitaminer og mineraler bidra til redusert kognitiv funksjon. PPI kan påvirke amyloide plakk og Tauprotein i hjernen (21), og svenske forskere mener at PPI kan påvirke syntesen av acetylkolin på en måte som øker risikoen for Alzheimers sykdom (22).
Flere store observasjonsstudier viser sprikende resultater. Mens noen ikke finner økt risiko, er inntil 40% økt risiko vist i andre. Igjen er det problematisk at mange av de inkluderte pasienter har høy alder, flere andre sykdommer og bruker flere andre legemidler (23).
Total dødelighet
Flere studier, av varierende kvalitet og generaliserbarhet, har pekt på assosiasjoner mellom PPI og tilstander som kronisk nyresykdom, atrofisk gastritt, mikroskopisk kolitt og demens. Det er altså mange potensielle effekter av PPI som kan ha negativ effekt på dødelighet.
Flere observasjonsstudier har undersøkt om det kan være noen sammenheng mellom totaldødelighet og bruk av PPI. Høy grad av komorbiditet og omfattende legemiddelbruk i pasientgruppen gjør at det er utfordrende å vurdere faktisk årsakssammenheng. I en stor registerstudie over amerikanske krigsveteraner fant forskerne en overdødelighet på 45,2 dødsfall per 1000 pasienter som tok PPI. Blant pasienter uten dokumentert indikasjon for PPI var det overdødelighet på grunn av kardiovaskulær sykdom, nyresykdom og kreft i øvre gastrointestinaltraktus uavhengig av om pasientene hadde hatt slik sykdom fra før. Økende varighet av behandlingen var assosiert med økende overdødelighet av alle årsaker (15).
Enkeltrapporter etter markedsføring har gitt grunnlag for spekulasjoner om PPI kan gi myalgi (lignende som statiner) (24).
Graviditet/amming
RELIS får ofte spørsmål om bruk av PPI hos gravide/ammende. Et standard svar er da at PPI kan brukes, dersom man ikke kommer til målet med syrenøytraliserende eller H2RA og dersom lege har vurdert at PPI er nødvendig. Ved amming er det et moment at PPI brytes ned av magesyren (derfor man gir enterotabletter) og at opptaket av intakt PPI til mors blod og videre til morsmelken er beskjedent. Videre kan PPI i morsmelken også passere gjennom diebarnets magesekk og degraderes i det sure miljøet der, slik at systemisk påvirkning av diebarnet er lite sannsynlig. Hvis gravide/ammende har behov for PPI anbefales generelt (es)omeprazol, da det er lengst/mest erfaring med denne. Sett i lys av det som er kjent om PPI og rebound/avhengighet kan det være fornuftig å informere kvinnene om dette. For gravide uten annen indikasjon for PPI foreslår vi at det lages en plan for nedtrapping etter fødsel (25).
Tiltak
Det viktigste tiltaket for å forhindre negative effekter av vedvarende PPI-bruk er tilbakeholdenhet med å starte behandlingen. PPI bør bare forskrives til pasienter med sikker indikasjon hvor PPI er dokumentert nyttig. H2RA kan i mange tilfeller være tilstrekkelig, og risikoen for rebound-effekter og alvorlige konsekvenser av langtidsbehandling er antakelig mindre enn for PPI. Pasienter med andre indikasjoner bør frarådes å kjøpe reseptfrie PPI, og ikke-farmakologiske tiltak bør anbefales. Avhengig av indikasjon kan dette dreie seg om røykeslutt, vekttap, fysisk aktivitet, endret liggestilling, redusert alkoholinntak, endret måltidshyppighet, eller rett og slett unngå inntak av mat eller drikke man erfaringsmessig vet forverrer situasjonen. Antacida kan være til nytte for enkelte pasienter. Dersom PPI vurderes som nødvendig, bør varigheten begrenses og lavest mulig dose benyttes. Et behandlingsforsøk bør ikke vare mer enn en uke før man vurderer effekten. Man kan da avbryte behandlingen før symptomer på grunn av rebound-syresekresjon blir problematiske.
For pasienter som bruker PPI uten sikker indikasjon bør legen diskutere fordeler og ulemper ved å fortsette behandlingen, inkludert risiko for alvorlige langtidseffekter. I mange tilfeller vil det være hensiktsmessig å forsøke nedtrapping og/eller utfasing av PPI. Apotek bør også informere pasienter som henter ut PPI, i det minste når det gjelder kjøp av reseptfrie produkter.
Cochrane har i en metaanalyse sammenlignet utfasing med fortsatt bruk av PPI hos voksne kroniske brukere med non-erosiv reflukssykdom eller lettgradig øsofagitt. Fem av de inkluderte studiene gjaldt overgang til ved-behov-medisinering, og i en studie ble PPI bråseponert. Oppsummert viste metaanalysen at fortsatt kontinuerlig bruk av PPI var assosiert med bedre symptomkontroll og lavere pasienttilfredshet enn utfasing/seponering. Forfatterne peker på at ingen av studiene målte positive effekter eller kostnader/ressursbruk ved å avslutte PPI (26).
Flere studier har vist at avhengig av avmedisineringsmetode vil en betydelig andel av pasientene (10-70%) ikke klare å trappe ned PPI (3). Pasientene må regne med at syrerelaterte problemer kan komme tilbake. Pasientedukasjon er viktig, for eksempel vil det være nyttig for mange å få informasjon om at sure oppstøt av og til er et normalfenomen som for eksempel kan være knyttet til enkelte typer mat. For de aller fleste seponeringesstudier som ikke lykkes med utfasing av PPI skjer tilbakefallet etter 3-4 uker. Blant dem som klarer seg uten PPI lenger enn dette er det svært få som gjenopptar PPI (3).
Det finnes mange forslag til fremgangsmåter for hvordan PPI skal trappes ned, men det mangler dokumentasjon på hva som er best. For legemidler som gir rebound-fenomener og seponeringssyndrom anbefales generelt langsom nedtrapping. Dette gjelder for eksempel benzodiazepiner, avsvellende nesespray og analgetika ved medikamentindusert hodepine. De studiene som finnes for PPI er i hovedsak av så kort varighet at man ikke kan slå fast nytten av intervensjonen, for eksempel i form av residiv av øsofagitt og blødning eller effekter på kreftutvikling, osteoporose og andre mulige alvorlige langtidseffekter. I mangel på sikker kunnskap mener vi algoritmen til den kanadiske organisasjonen deprescribing.org kan være et godt utgangspunkt (Figur 5). Etter dosereduksjon eller seponering foreslås her ikke-medikamentelle tiltak samt eventuelt bruk av antacida, H2RA eller PPI ved behov alt etter hva pasienten foretrekker. Algoritmen anbefaler oppfølging etter 4-12 uker, og det finnes en pasientbrosjyre som skal styrke pasientengasjementet (27).
For omeprazol eller esomeprazol anbefaler Norsk legemiddelhåndbok 50% dosereduksjon ukentlig inntil laveste mulige dosering er oppnådd. Etter ytterligere 1 uke på denne dosen kan PPI seponeres. Ved noen diagnoser kan pasienten eventuelt gå over til intermitterende, symptomstyrt behandling (28).
Den svenske avmedisineringsboken FAS-UT anbefaler at PPI uansett dose kan bråseponeres dersom behandlingen har vart i mindre enn en måned på grunn av liten risiko for rebound-problematikk. Ved mer langvarig behandling, anbefales halv dose daglig i 4. uker og deretter annenhver dag i de påfølgende 4 ukene før PPI avsluttes helt. Etter avslutning kan antacida brukes ved behov. Dersom reboundsymptomene ikke lindres helt, kan antacida suppleres med ranitidin 150mg (29). Dette vil gi raskere symptomlindring og lavere risiko for å opprettholde rebound-fenomenet enn ved fortsatt bruk av PPI.
KONKLUSJON
Bruken av PPI i befolkningen er omfattende, særlig blant eldre, og flere studier tilsier at langtidsbruk kan gi alvorlige bivirkninger selv om behandlingen vanligvis ser ut til å tolereres godt. Behandling bør bare skje på sikker indikasjon og over kortest mulig tid. Nedtrapping over noen uker er ofte nødvendig på grunn av rebound-effekter. Ikke-medikamentelle tiltak og eventuelt tillegg av antacida eller H2-blokker ved behov anbefales. PPI er mindre effektivt tatt som enkeltdoser, noe som øker risikoen for (ny) oppskalering til fast bruk.
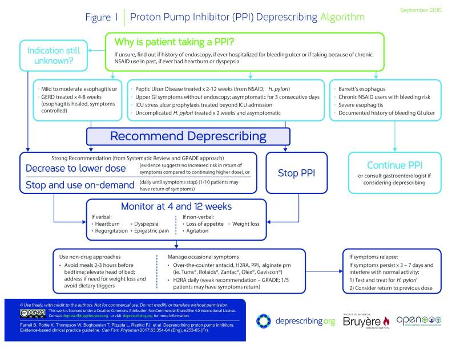
Figur 5: Nedtrappingsalgoritme for PPI fra canadiske deprescribing.org.
Referenser
- Ibanez B, James S et al. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: The Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J 2017; 39(2): 119–77.
- RELIS database 2019; spm.nr. 7680, RELIS Midt-Norge. www.relis.no
- Helgadottir H, Bjornsson ES. Problems Associated with Deprescribing of Proton Pump Inhibitors. Int J Mol Sci 2019; 20: 5469.
- Halfdanarson OO, Pottegard A et al. Proton-pump inhibitors among adults: A nationwide drug-utilization study. Therap Adv Gastroenterol 2018; 11: 1756284818777943.
- Pottegard A, Broe A et al. Use of proton-pump inhibitors among adults: A Danish nationwide drug utilization study. Therap Adv Gastroenterol. 2016; 9: 671–8.
- Wolfe MM. Proton pump inhibitors: Overview of use and adverse effects in the treatment of acid related disorders. Version 44.0. In:UpToDate. https://www.helsebiblioteket.no/ (Sist oppdatert: 09.04.2020).
- Liu J, Li X et al. Proton pump inhibitors therapy and risk of bone diseases: An update meta-analysis. Life Sciences 2019; 218, 213-23.
- Urbas R, Huntington W et al. Malabsorption-Related Issues Associated with Chronic Proton Pump Inhibitor Usage. Austin J Nutr Metab 2016; 3(2): 1041.
- Leonard J, Marshall JK et al. Systematic review of the risk of enteric infection in patients taking acid suppression. Am J Gastroenterol 2007; 102(9): 2047.
- Bradley ES, Howe E et al. Proton pump inhibitors and 180-day mortality in the elderly after Clostridium difficile treatment. Gut Pathog 2019; 11: 29.
- Waldum HL, Sørdal Ø et al. Proton pump inhibitors (PPIs) may cause gastric cancer – clinical consequences. Scand J Gastroenterol 2018; 53(6): 639-42.
- Tran-Duy A, Spaetgens B et al. Use of Proton Pump Inhibitors and Risks of Fundic Gland Polyps and Gastric Cancer: Systematic Review and Meta-analysis. Clin Gastroenterol Hepatol 2016; 14: 1706–1719.e5.
- Wan Q Y, Wu X et al. Long-term proton pump inhibitors use and risk of gastric cancer: a meta-analysis of 926 386 participants. Gut 2019: 68(4): 762-4.
- Liu P, McMenamin ÚC et al. Use of proton pump inhibitors and histamine-2 receptor antagonists and risk of gastric cancer in two population-based studies. Br J Cancer 2020; 123(2): 307-15.
- Xie Y, Bowe B et al. Estimates of all cause mortality and cause specific mortality associated with proton pump inhibitors among US veterans: cohort study. BMJ 2019; 365: 1580.
- Gueta I, Halkin H et al. Proton pump inhibitors and the risk for gastric cancer: possible confounding by serum vitamin B 12. Gut 2018; 67: 1904.
- Alkhushaym N, Almutairi AR et al. Exposure to proton pump inhibitors and risk of pancreatic cancer: a meta-analysis. Expert Opin Drug Saf 2020; 19(3): 327-34.
- Brusselaers N, Sadr-Azodi O et al. Long-term proton pump inhibitor usage and the association with pancreatic cancer in Sweden. J Gastroenterol 2020; 55: 453–61.
- Manolis AA, Manolis TA et al. Proton pump inhibitors and cardiovascular adverse effects: Real or surreal worries? Eur J Internal Med 2020; 72: 15-26.
- Shih CJ, Chen YT et al. Proton pump inhibitor use represents an independent risk factor for myocardial infarction. Int J Cardiol 2014; 177(1): 292-7.
- Ortiz-Guerrero G, Amador-Muñoz D et al. Proton Pump Inhibitors and Dementia: Physiopathological Mechanisms and Clinical Consequences. Neural Plast 2018; 2018: 5257285.
- Kumar R, Kumar A et al. Proton pump inhibitors act with unprecedented potencies as inhibitors of the acetylcholine biosynthesizing enzyme-A plausible missing link for their association with incidence of dementia. Alzheimers Dement 2020; 16(7): 1031-42.
- Keepe CD, Montine TJ et al. Epidemiology, pathology, and pathogenesis of Alzheimer disease. Version 16.0. In: UpToDate. https://www.helsebiblioteket.no/ (Sist oppdatert: 19. januar 2018).
- Nordmo EN, Vorren S. Kan protonpumpehemmere gi myopati/nevropati? /content/5121/Kan-protonpumpehemmere-gi-myopati-nevropati (Publisert 26. Juni 2020).
- Norvik M, Eriksen AK. Behandlingstrapp ved sure oppstøt og halsbrann hos gravide. /content/5028/Behandlingstrapp-ved-sure-oppstot-og-halsbrann-hos-gravide (Publisert 20. Juni 2019).
- Boghossian TA, Rashid FJ et al. Deprescribing versus continuation of chronic proton pump inhibitor use in adults. Cochrane Database Syst Rev 2017; 3: CD011969.
- Deprescribing.org. Proton Pump Inhibitor deprescribing algorithm. https://deprescribing.org/wp-content/uploads/2018/08/ppideprescribing-algorithm_2018_En.pdf (Oppdatert august 2018).
- Norsk legemiddelhåndbok. Forslag til nedtrapping for legemidler som bør trappes ned gradvis før seponering. https://www.legemiddelhandboka.no/G27.10.1/Tabell_1:_Forslag_til_nedtrapping_for_legemidler_som_bør_trappes_ned_gradvis_før_seponering. (Sist endret 18. Juli 2018)
- Lundgren C. Protonpumpehemmere. I: Lundgren C. FAS UT 3. Skellefteå: In Question AB. 2010: 30-1.
Forfattere
