Hvordan beskytter diabetesmedisin hjerte, nyre og hjerne?
- Publicerad: 23.05.2023
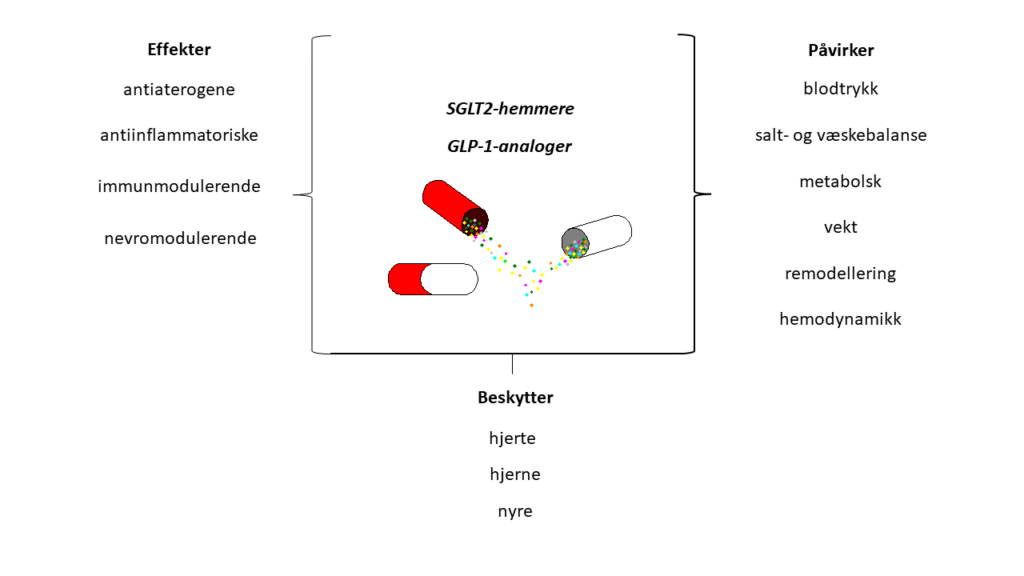
To typer av diabetesmedisin, natriumglukose-kotransportør 2-hemmere (SGLT2-hemmere) og glukagonlignende peptid-1-reseptoragonister (GLP-1-analoger), er i dag også aktuelle som behandling ved hjerte-, kar-, og nyresykdom. Dette har bakgrunn i et krav fra Food and Drug Administration (FDA) i 2008 om å undersøke om diabetesmedisin medførte økt risiko for hjerte-karsykdom (1). Kravet fra FDA motiverte en rekke studier som viste at diabetesmedisin faktisk hadde beskyttende effekter i forhold til kardiovaskulære og kardiorenale kliniske endepunkter. Flere av de beskyttende effektene er trolig uavhengig av effekt på HbA1c, og dette aktualiserer bruk av legemidlene hos pasienter med hjerte-, kar-, og nyresykdom med normal blodsukkerkontroll.
Kliniske funn
Hos pasienter med symptomatisk kronisk hjertesvikt med redusert ejeksjonsfraksjon (< 40 %) blir SGLT2-hemmere nå anbefalt for å redusere sykehusinnleggelser og kardiovaskulær mortalitet uavhengig av om pasienten har type 2 diabetes (2). SGLT2-hemmere er også vist å redusere den kombinerte risikoen for forverring av hjertesvikt og kardiovaskulær død hos pasienter med hjertesvikt med bevart ejeksjonsfraksjon (2, 3). Pasienter med bevart ejeksjonsfraksjon utgjør ca. 50% av pasienter med hjertesvikt (4). Vi vet foreløpig for lite om hvilken nytteverdi disse legemidlene har hos afroamerikanske pasienter, og hos pasienter med hjertesvikt forårsaket av kardiomyopati (5). SGLT2-hemmere er også vist å beskytte mot forverring av nyrefunksjon, nyresvikt, og død fra renal eller kardiovaskulær årsak (6, 7).
GLP-1-analoger er vist å gi beskyttelse ved kardiovaskulær sykdom og slag ved å forsinke debut av MACE («tid til første hendelse av enten kardiovaskulær død, ikke-fatalt hjerteinfarkt eller slag»). Risiko-reduksjonen ligger rundt 15 % (8). Gliptiner (DPP-4-hemmere) har i motsetning til SGLT2-hemmere og GLP-1-analoger vært nøytrale i forhold til effekt på kardiovaskulær sykdom (9).
Kliniske studier med SLGT2-hemmere eller GLP-1-analoger har vist blodtrykkssenkende egenskaper. Systolisk blodtrykk reduseres med 3-5 mmHg, og diastolisk blodtrykk med 2-3 mmHg (10). En så moderat reduksjon i blodtrykk vil ikke kunne forklare de gunstige effektene på kardiovaskulær sykdom observert i kliniske studier. Glykemisk kontroll, andre metabolske effekter, samt vekt- og blodtrykksreduksjon kan muligens forklare noen av observasjonene, men en rekke spesifikke mekanismer er foreslått i litteraturen. Her beskrives noen eksempler.
Mekanismer
En foreslått mekanisme for en beskyttende effekt av SGLT2-hemmere i nyrene er reduksjon i glomerulært trykk og proteinuri. Legemidlenes natriuretiske egenskaper, og evne til å gi osmotisk diurese, senker trykket i glomeruli. Forbigående reduksjon i GFR bidrar til å bevare GFR over tid (11). Renal hemodynamikk endres, og en forslått mekanisme er økt tonus i afferent arteriole (12). Dilatasjon av efferent arteriole er også foreslått (13). I dyrestudier er en relasjon mellom GLP-1 reseptor signalering, atrialt natriuretisk peptid (ANP) og renal utskillelse av natrium beskrevet (14). For GLP-1-analoger er redusert endotelial inflammasjon og oksidativt stress med økt nitrogenoksyd (NO), og hemming av blodplater, påvist i prekliniske studier (13). Redusert endotel inflammasjon og antioksydative mekanismer vil være av betydning for hjerte, men også hjerne, og kan påvirke utvikling av aterosklerose.
En del av disse effektene av GLP-1-analoger er muligens uavhengige av binding til GLP-1 reseptoren basert på manglende utrykk av denne i vev (14). Forslag til mekanismer og effekter for SGLT2-hemmere og GLP-1-analoger er hovedsakelig basert på in vitro, ex vivo og heldyrsstudier, og listen over nye funn øker stadig. Eksempelvis er immunmodulerende (interleukiner, cytokiner), nevrale (sympatikushemmende), og nevroprotektive (redusert nevroinflammasjon) effekter assosiert med legemidlene.
Komplementære effekter
SGLT2-hemmere og GLP-1-analoger er foreslått å ha komplementære effekter i forhold til kardiovaskulær og kardiorenal beskyttelse. Mens SGLT2-hemmere kan påvirke natriurese og hemodynamikk (f.eks. diurese, preload, afterload), kan GLP-1-analoger påvirke inflammasjon, åreforkalkning og metabolske effekter (15). Begge legemiddelgrupper vil ha additive beskyttende effekter på organer som hjerte, hjerne og nyre. Legemidlene har lik effekt på MACE, mens SGLT2-hemmere har større effekt ved hjertesvikt og utvikling av kronisk nyresykdom. GLP-1-analoger synes viktigst for å forebygge hjerneslag (15).
Oppsummering og perspektiv
Diabetesmedisin er i dag også aktuell behandling hos pasienter som har normal blodsukkerkontroll, og en rekke nye mekanismer er oppdaget etter at medisinene er kommet i klinisk bruk. Mekanismene aktualiserer ideer om sekundærbruk av eksisterende legemidler, og skiller seg fra moderne legemiddelutvikling hvor mekanismer «designes» ut fra basalkunnskap, og utprøves preklinisk før markedsføring.
Hvilke effekter som er viktigst for de kliniske observasjonene kan være vanskelig å definere, men hemodynamikk, og påvirkning av risikofaktorer i blod og karvegg, er viktige både i hjerte, nyre og hjerne.
Ny kunnskap om effekter av diabetesmedisin gir optimisme blant klinikere og forskere, men hvilken plass de får i behandling avgjøres av nytte, bivirkninger og kostnader (16, 17). Et moment er også at legemidlene er aktuelle ved tilstander forbundet med polyfarmasi hvor risiko for interaksjoner og redusert etterlevelse kan bli et problem.
Referenser
- Department of Health and Human Services: USFood and Drug Administration. 73 FR 77724–guidance for industry on diabetes mellitus: evaluating cardiovascular risk in new antidiabetic therapies to treat type 2 diabetes: availability. Fed Regist 2008; 73: 77724–77725.
- 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure. JACC 2022; 79(17): e263-e421.
- Solomon SD, McMurray JJV et al. Dapagliflozin in Heart Failure with Mildly Reduced or Preserved Ejection Fraction. N Engl J Med 2022; 387: 1089-1098.
- Virani SS, Alonso Aet al. Heart disease and stroke statistics — 2020 update: a report from the American Heart Association. Circulation 2020; 141(9): e139-e596.
- Margulies KB. DELIVERing Progress in Heart Failure with Preserved Ejection Fraction. N Engl J Med 2022; 387: 1138-1140.
- Heerspink HJL, Stefánsson BV et al. Dapagliflozin in Patients with Chronic Kidney Disease. N Engl J Med 2020; 383: 1436-1446.
- Cherney DZI, Dekkers CCJ et al. Effects of the SGLT2 inhibitor dapagliflozin on proteinuria in non-diabetic patients with chronic kidney disease (DIAMOND): a randomised, double-blind, crossover trial. Lancet Diabetes Endocrinol 2020; 8: 582-593.
- Marx N, Husain M et al. GLP-1 Receptor Agonists for the Reduction of Atherosclerotic Cardiovascular Risk in Patients With Type 2 Diabetes. Circulation 2022; 146(24): 1882-1894.
- Davies MJ, Drexel H et al. Cardiovascular outcomes trials: a paradigm shift in the current management of type 2 diabetes. Cardiovascular Diabetology 2022; 21: 144.
- Brown E, Heerspink HJL et al. SGLT2 inhibitors and GLP-1 receptor agonists: established and emerging indications. Lancet 2021; 398: 262-76.
- Baily CJ, Day C et al. Renal Protection with SGLT2 Inhibitors: Effects in Acute and Chronic Kidney Disease. Current Diabetes Reports 2022; 22(1): 39-52.
- Gronda EG, Vanoli E et al. Renal effects of SGLT2 inhibitors in cardiovascular patients with and without chronic kidney disease: focus on heart failure and renal outcomes. Heart Failure Reviews (2023) 28:723–732.
- van Bommel EJM, Muskiet MHA et al. The renal hemodynamic effects of the SGLT2 inhibitor dapagliflozin are caused by post-glomerular vasodilatation rather than pre-glomerular vasoconstriction in metformin-treated patients with type 2 diabetes in the randomized, double-blind RED trial. Kidney Int 2020; 97: 202-212.
- Helmstädter J, Keppeler K et al. Glucagon-like peptide-1 (GLP-1) receptor agonists and their cardiovascular benefits—The role of the GLP-1 receptor. Br J Pharmacol 2022; 179: 659–676.
- Gourdy P, Darmon P et al. Combining glucagon-like peptide-1 receptor agonists (GLP-1RAs) and sodium-glucose cotransporter-2 inhibitors (SGLT2is) in patients with type 2 diabetes mellitus (T2DM). Cardiovascular Diabetology 2023; 22: 79.
- Birkeland KI, Meling S et al. Nye internasjonale anbefalinger for type 2-diabetes – hva gjør vi i Norge? Tidsskr Nor Legeforen 2023. doi: 10.4045/tidsskr.22.0672
- Åsvold BO. Nye diabetesmidler – til nytte for mange, til skade for noen. Tidsskr Nor Legeforen 2023. doi: 10.4045/tidsskr.23.0059
