Riktigere bruk av legemidler mot migrene
- Publicerad: 18.10.2023
BAKGRUNN OG HENSIKT
Migrene forekommer hos anslagsvis 15 % av kvinner og 6 % av menn i Norge (1).
Migrene regnes som den andre største årsaken til sykelighet i verden, og den største blant kvinner under 50 år (2). Konsekvensen av migrene er ikke bare smerter og redusert livskvalitet for den enkelte pasient, men også høye samfunnskostnader relatert til sykefravær og økt bruk av helseressurser (3). Riktig behandling av migrene er viktig for å ivareta funksjonsevne og livskvalitet hos pasienten og redusere samfunnets kostnader.
Migrene er en episodisk hodepinelidelse som kjennetegnes av anfall med oftest ensidig hodepine av pulserende karakter. Hodepinen kan ledsages av kvalme, lys- og lydskyhet og forverres ved fysisk anstrengelse. Omtrent en tredjedel av migrenepasienter har aura. Migreneaura er fokale nevrologiske symptomer, oftest visuelle, som vanligvis utvikles gradvis over 5–20 minutter og varer under 60 minutter. Aura kan forekomme uten påfølgende hodepine (4).
Migrene antas å være en nevrovaskulær sykdom, hvor genetisk disposisjon gjør hjernen mer mottakelig for en rekke endogene og eksogene triggerfaktorer. Man antar at migrene er et uttrykk for endret elektrisk aktivitet i hjernebarken, med påfølgende aktivering av det trigeminovaskulære systemet. Migreneaura skyldes sannsynligvis en forbigående langsomt utbredende depolarisering av nevroner, såkalt cortical spreading depression, som typisk starter oksipitalt og brer seg fremover i hjernebarken. Hodepinen skyldes sannsynligvis aktivering av nociseptorer i hjernehinner og cerebrale blodkar, og sekundært økt smertefølsomhet i sentralnervesystemet (4, 5).
For å stille diagnosen migrene skal pasienten ha hatt minst to hodepineanfall med aura, eller fem anfall uten aura, av en varighet på 4–72 timer, med minst to av følgende karakteristika: 1) ensidig, 2) pulserende, 3) moderate til sterke smerter, eller 4) forverring ved fysisk aktivitet. Hodepinen skal ha minst ett av følgende ledsagende symptom: 1) kvalme og/eller oppkast, eller 2) overfølsomhet for lyd og lys (6). Man skiller mellom episodisk og kronisk migrene, der kronisk migrene er definert som hodepine i 15 dager eller mer per måned i mer enn tre måneder, der hodepinen minst åtte av dagene er av migrenekarakter (6).
MOH er den vanligste komplikasjonen ved migrenebehandling (7). Alle typer analgetika (inkludert triptaner), alene eller i kombinasjon, kan forårsake MOH. Det er antall dager administrert per måned og ikke dosen som bidrar til MOH (7).
Hensikten med denne artikkelen er å gi en oversikt over legemiddelalternativer ved anfallsbehandling og forebyggende behandling av migrene i en norsk setting. Vi vil ha fokus på dokumentert klinisk effekt av aktuelle legemidler, og ønsker å formidle generelle anbefalinger om bruk av migrenemidler i praksis og den behandlingsrelaterte komplikasjonen MOH.
MATERIALE OG METODER
Dette er en redaksjonelt etterspurt faglig oppdatering som tar utgangspunkt i en oversiktsartikkel om emnet publisert i Norsk Farmaceutisk Tidsskrift i 2015 (8). Oppdateringen bygger på et skjønnsmessig utvalg av nyere artikler funnet ved usystematiske søk i PubMed, sammenstilt med norske og internasjonale retningslinjer (4, 9, 10). Vi har i hovedsak forholdt oss til metaanalyser og oversiktsartikler, og kun norsk- og engelskspråklige artikler er inkludert.
Mye av arbeidet bak denne oppdateringsartikkelen er gjort i forbindelse med KUPPkampanjen Riktigere bruk av legemidler mot migrene. KUPP (kunnskapsbaserte oppdateringsvisitter) er et samarbeidsprosjekt mellom RELIS og de klinisk farmakologiske enhetene ved universitetssykehusene. Kampanjen er utarbeidet i samarbeid med norske kolleger med spesiell kompetanse på migrene, deriblant spesialister i nevrologi, allmennmedisin og pediatri. Siste litteratursøk er gjort 18. april 2023.
ANFALLSBEHANDLING
Anfallsbehandling er det første, og ofte det viktigste, steget i migrenebehandling. Behandlingen er som regel mer effektiv tidlig i et anfall og bør igangsettes så raskt som mulig ved hodepinestart. Det er viktig at anfallsbehandling tilpasses den enkelte pasients symptombilde, som intensitet og varighet av hodepinen, kvalme og eventuelt aura (4, 10).
Legemidler til anfallsbehandling inkluderer analgetika som ikke-steroide antiinflammatoriske midler (NSAID), paracetamol, triptaner, samt antiemetika ved kvalme. NSAID og/eller paracetamol er førstevalg, deretter forsøkes triptaner, mens kombinasjon av triptan og naproksen regnes å være tredjevalget (4).
En ny anfallsmedisin, rimegepant, ble nylig tilgjengelig i Norge. Rimegepant er en hurtigvirkende kalsitoningenrelatert peptid (CGRP)-hemmer som diskuteres i avsnittet for CGRP-hemmere. Ergotamin anbefales ikke lenger som anfallsbehandling i Norge, men tas noen ganger i bruk ved status migrenosus (anfall som varer lenger enn 72 timer). Ved status migrenosus kan også kortikosteroider vurderes (4, 10).
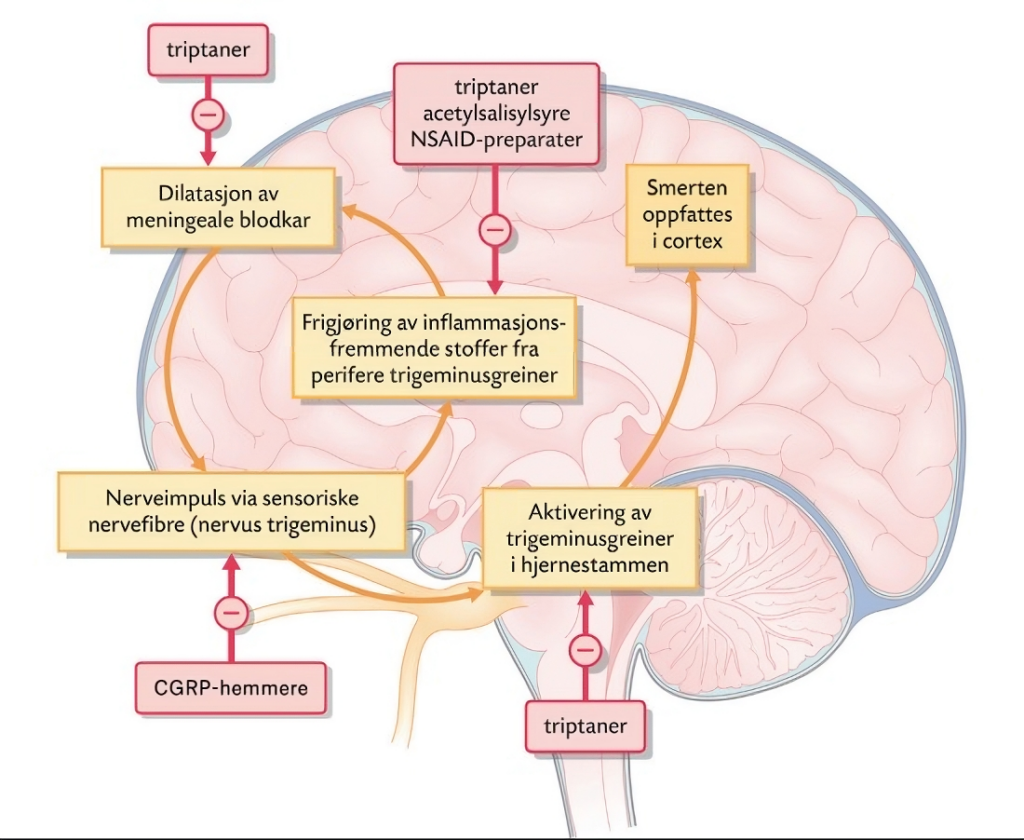
Flere av legemidlene retter seg mot å dempe inflammasjon, redusere sensitivitet i perifere trigeminusgrener og virke kontraherende på meningeale blodkar (figur 1).
Analgetika
Til behandling av mild til moderat migrene er analgetika som paracetamol og NSAID som acetylsalisylsyre, ibuprofen og naproksen anbefalte førstevalg (11, 12). Disse kan kjøpes reseptfritt i lave doser og/eller små pakninger, er lett tilgjengelige og er rimeligere enn mange alternative migrenemidler. Diklofenak er ikke inkludert blant førstevalgene på grunn av hjerte- og karbivirkninger. Noen legemidler finnes også i kombinasjon med koffein. Studier har vist at kombinasjoner med koffein gir økt grad av smertefrihet og funksjon (13). Mekanismen er ikke fullstendig klarlagt, men kan potensielt forklares blant annet av vasokonstriksjon etter oppregulering av adenosinreseptorer, samt reduksjon av nociseptive nervesignaler og nedregulering av COX-enzymet (11, 14).
Opioidanalgetika som tramadol og kodein er ikke indisert ved behandling av migrene i Norge, men forskrives likevel ved ulike hodepinetilstander. Disse legemidlene har dårligere evidensgrunnlag for effekt enn migrenespesifikke legemidler og er forbundet med større bivirkningsproblematikk (15, 16).
Triptaner
Triptaner virker ved å stimulere serotonin (5-HT1)-reseptorer i blodkar i det trigeminovaskulære system. Dette fører til sammentrekning av dilaterte blodkar og hemming av smerteimpulser formidlet gjennom trigeminusnerven (figur 1). For best effekt bør triptaner tas så tidlig som mulig i hodepinefasen (4). Pasienter med aura skal ikke ta triptaner i aurafasen (17), da dette reduserer effekt av triptaner på hodepinesymptomene (18) og behandling i aurafasen kan tenkes å øke risiko for hjerneinfarkt (4).
Valg av triptan vil avhenge av individuelle behov, der ulike farmakologiske egenskaper og administrasjonsformer vil være retningsgivende. I tilfeller hvor raskt innsettende effekt er nødvendig anbefales injeksjon eller nesespray (10).
Ved lindring, men ikke full effekt på symptomer etter første dose, kan ny dose tas etter minimum 2 timer (for injeksjon minimum 1 time). Ved fravær av effekt etter første dose oppnår man ingenting ved å gjenta dosen etter 1–2 timer. Man bør ved neste anfall i stedet øke dosen av samme triptan, endre administrasjonsform eller forsøke et annet triptan (1). Det anbefales at pasienten tidlig får prøve flere ulike triptaner i ulike formuleringer (tabell 1).
Blant de hyppigst rapporterte bivirkningene er kvalme, klemmende fornemmelse i bryst- og halsregionen, varme og rødme i hud og prikking i fingre og tær. Disse er vanligvis av kortvarig karakter. Tretthet er en annen vanlig bivirkning ved bruk, og forholdsregler må tas med hensyn til bilkjøring (4, 10).
Antiemetika
Behandling med kvalmestillende midler er anbefalt for å motvirke kvalme og oppkast som ofte ledsager et migreneanfall. Kvalmestillende legemidler kan også motvirke nedsatt mage- og tarmaktivitet ved migreneanfall, og dermed fremme absorpsjonen av anfallskuperende legemidler. Metoklopramid kan også ha additiv smertestillende effekt ved migrene (19).
Kombinasjonen av metoklopramid med acetylsalicylsyre eller paracetamol har vist lik effekt på migrenerelaterte smerter som sumatriptan (3), i tillegg til kvalmestillende effekt. Det anbefales å begrense dosering og behandlingstid (for voksne: 10 mg inntil 3 ganger daglig i opptil 5 dager) for å redusere risikoen for alvorlige nevromuskulære bivirkninger. Ondansetron kan brukes, men foretrekkes ikke grunnet risiko for forlenget QT-tid samt noe høyere pris (4).
Valg av administrasjonsform
Ved migreneanfall ses ofte forsinket ventrikkeltømming på grunn av gastrisk stase, og perorale legemidler kan få forsinket absorpsjon og dermed forsinket effekt (18). Kvalme og oppkast kan også gi redusert opptak av legemidlene. I slike tilfeller vil det være mer hensiktsmessig å velge en administrasjonsform der effekten ikke avhenger av ventrikkeltømming og gastrointestinal absorpsjon, som nesespray eller subkutan injeksjon. Smeltetabletter kan være et alternativ for pasienter med svelgevansker, eller i situasjoner hvor væske ikke er tilgjengelig (4, 10) (tabell 1).
Medikamentoverforbrukshodepine
Medikamentoverforbrukshodepine (MOH) defineres som kronisk hodepine > 15 dager i måneden med kjent overforbruk av analgetika. Omtrent 1–2 % av befolkningen lider av MOH, og omtrent 65 % har migrene som grunnsykdom. Mekanismen er foreløpig ikke fullstendig utredet, men sentral sensitivering (for eksempel ved nedregulering av serotoninreseptorer i sentralnervesystemet), som ved migrene, virker å spille en rolle (20). Alle de vanligste anfallslegemidlene kan føre til MOH ved langvarig, høyt forbruk. Bruk av NSAID og andre analgetika bør begrenses til mindre enn 14–15 dager per måned, mens bruk av triptaner bør begrenses til maksimum 9 dager per måned (2, 6). Pasienter som bruker slike midler oftere enn dette, bør oppfordres til å snakke med legen sin om forebyggende behandling for å redusere bruk av anfallsbehandling (21).
Behandling av MOH er seponering av det overforbrukte legemidlet/legemidlene, og omtrent 75 % oppnår en betydelig bedring dersom de unngår overforbruk av analgetika. Forebyggende behandling reduserer hodepinefrekvens (21) og bidrar til redusert behov for anfallsbehandling, og er dermed også viktig i behandlingen av MOH. Det er fremdeles diskusjon internasjonalt om forebyggende behandling skal startes umiddelbart ved seponering av anfallsmedisin eller om man skal vente noen måneder etter seponering (22). I Norge anbefales det å avvente forebyggende behandling i 2–3 måneder, til anfallsmønsteret etter seponering av analgetika er avklart (23, 24).
Tabell 1. Anfallsbehandling hos voksne
VIRKESTOFF (PREPARATNAVN*) | DOSERING | TID MELLOM DOSER | MAKSDOSE PER DØGN | REFUSJON VED MIGRENE |
Paracetamol (Paracet) | 1000 mg | 4–6 timer | 4000 mg | Tiger Nixon |
Acetylsalisylsyre (Aspirin) | 1000 mg | 4–6 timer | 3000 mg | Tiger Nixon |
Ibuprofen (Ibux) | 400–600 mg | 4–6 timer | 2400 mg | Tiger Nixon |
Naproksen | 750 mg | 12 timer | 1250 mg | Ja, T-§2** |
Sumatriptan (Imigran) | Tabletter 50–100 mg | Minimum 2 timer | 300 mg | Ja, T-§2 |
Injeksjon 6 mg | Minimum 1 time | 12 mg | ||
Nesespray 20 mg | Minimum 2 timer | 40 mg | ||
Zolmitriptan (Zomig) | Tabletter 2,5–5 mg | Minimum 2 timer | 10 mg | Ja, T-§2 |
Smeltetabletter 2,5 mg | Minimum 2 timer | 10 mg | ||
Nesespray 5 mg | Minimum 2 timer | 10 mg | ||
Naratriptan (Naramig) | Tabletter 2,5 mg | Minimum 4 timer | 5 mg | Ja, T-§2 |
Rizatriptan (Maxalt) | Tabletter 5–10 mg | Minimum 2 timer | 20 mg | Ja, T-§2 |
Smeltetabletter 10 mg | Minimum 2 timer | 20 mg | ||
Almotriptan (Almogran) | Tabletter 12,5 mg | Minimum 2 timer | 25 mg | Ja, T-§2 |
Eletriptan (Relpax) | Tabletter 20–40 mg | Minimum 2 timer | 80 mg | Ja, T-§2 |
Metoklopramid (Afipran) | 10–20 mg | 8 timer | 30 mg (0,5 mg/kg) | Nei |
Meklozin (Postafen) | 25–50 mg | 12 timer | 50 mg | Nei |
Proklorperazin (Stemetil) | 10–20 mg | 8 timer | 30 mg | Nei |
Forkortelser: T-§2: Forhåndsgodkjent refusjon, blå resept, §2, N89/G43 * Mest kjente produktnavn i Norge ** Gjelder naproksen vanlige tabletter, ikke enterodrasjerte. I tillegg har diklofenak (Cataflam) og tolfenamsyre (Migea) forhåndsgodkjent refusjon, blå resept, §2, N89/G43 som anfallskuperende behandling, men disse er ikke i våre anbefalinger på grunn av sikkerhetsprofilen.
Tabell 2. Legemidler i forebyggende migrenebehandling
LEGEMIDDEL | REFUSJON | ANBEFALING | DØGNDOSE | INDIKASJONER |
Propranolol | Ja, T-§2 | Sterk | 80–240 | Migrene, hypertensjon, tremor, takyarytmier, angina pectoris, hjerteinfarkt, tyreotoksikose |
Kandesartan | Ja, T-§2 | Sterk | 50–150 | |
Lisinopril | Nei | Sterk | 20 | Hypertensjon, hjertesvikt |
Amitriptylin | Ja, T-§2 | Sterk | 10–100 | Migrene, depresjon, nevropatisk smerte, spenningshodepine |
Venlafaksin | Nei | Moderat | 300 mg | Depresjon (episode, profylakse), angst (generalisert, sosial, panikk) |
Topiramat | Ja, T-§2 | Sterk | 25–100 | Migrene, epilepsi |
Valproat | Nei | Svak | 300–1800 | Epilepsi, bipolar lidelse |
Flunarizin | Nei, reg.fritak | Svak | 5–10 | Hypertensjon, angina pectoris |
REFUSJON | INDIKASJONER | |||
Erenumab | Ja, T-§3 | Profylakse mot migrene hos voksne som har minst 4 migrenedager per måned | ||
Eptinezumab | Ja, dekkes av HF | Profylakse mot migrene hos voksne som har minst 4 migrenedager per måned | ||
Rimegepant | Nei | Akutt behandling av migrene med eller uten aura. Profylakse mot migrene hos voksne som har minst 4 migrenedager per måned | ||
Botulinumtoksin | Ja, T-§3 | Kronisk migrene |
Forkortelser: T-§2: Forhåndsgodkjent refusjon, blå resept, §2, N89/G43 T-§3: Refusjon blå resept på individuell søknad fra spesialist i nevrologi (eller pediatri) Reg.fritak: Har ikke markedsføringstillatelse i Norge, må rekvireres på egen resept for registreringsfritak.
1. Basert på: Dokumentasjons- og anbefalingsgrunnlag for forebyggende legemidler. Erling Andreas Tronvik (upublisert bokkapittel).
FOREBYGGENDE BEHANDLING
Omtrent 25 % av migrenepasientene har behov for forebyggende behandling, men kun cirka 10 % bruker det (4). Forebyggende migrenebehandling bør overveies når hodepinen gir redusert livskvalitet til tross for optimalisert anfallsbehandling. I praksis bør pasienter med tre eller flere månedlige migreneanfall få tilbud om forebyggende behandling, men tre bør ikke oppfattes som en absolutt grense. Faktorer som alvorlighetsgrad og varighet av anfall, funksjonsevne og respons på behandling bør også tas med i betraktningen (4).
Forebyggende behandling er også aktuelt ved MOH, eller ved manglende effekt av, bivirkninger av eller kontraindikasjoner mot anfallsbehandling (4, 25).
Målet med forebyggende migrenebehandling er reduksjon i frekvens, intensitet og varighet av anfallene, ikke nødvendigvis anfallsfrihet (25, 26). Det tar noe tid før effekten av forebyggende behandling kan dokumenteres, og en bør helst vente minst 12 uker før andre alternativer forsøkes.
Sett bort fra CGRP-hemmerne, har effekten av forebyggende legemidler blitt tilfeldig oppdaget ved bruk mot andre komorbide tilstander. Virkningsmekanismene ved migreneforebygging er ikke fullstendig kartlagt, men ser ut til å involvere undertrykking av eksitatorisk nervesignalering via kalsium- og/eller natriumreseptorer, økt gamma-aminosmørsyre (GABA)-mediert inhibering, hemming av kortikal depolarisering (cortical spreading depression) og nevronal sensibilisering, samt reduksjon i nivå av CGRP (27).
Tabell 2 viser en oversikt over migreneforebyggende legemidler. Anbefalingen for bruk (Sterk>Moderat>Svak) er basert på klinisk erfaring, effektdokumentasjon, bivirkningsprofil, kontraindikasjoner, refusjonsstatus og tilgjengelighet (28). Det er få gode studier som sammenlikner effekten av de ulike migreneforebyggende legemidlene opp mot hverandre. Dermed kan ingen av legemidlene med sikkerhet sies å være mer effektivt enn et annet. Valg av legemiddel bør av den grunn gjøres ut fra effektdokumentasjon, komorbiditet, kontraindikasjoner, bivirkninger og pris (inkludert refusjonsmulighet). Det finnes likevel noen legemidler som trekkes frem som førstevalg basert på effektdokumentasjon, bivirkningsprofil og pris: metoprolol, propranolol, kandesartan og amitriptylin. Monoterapi bør foretrekkes, da det ikke er vist noen fordel ved å bruke mer enn ett legemiddel med mindre pasienten har flere komorbide tilstander (25).
Betablokkere, amitriptylin og kandesartan er førstevalg
Betablokkere har det beste dokumentasjonsgrunnlaget blant de tradisjonelle legemiddelklassene brukt til migreneforebygging (29). Blant disse er det propranolol og metoprolol som har best dokumentasjon, og begge legemidlene er refusjonsberettiget på blå resept ved indikasjon migreneprofylakse. Depotformulering foretrekkes. For noen pasienter, for eksempel ved bradyarytmier eller astma, bør andre legemidler velges. Bivirkninger som nedsatt fysisk kapasitet, tretthet, blodtrykksfall, kalde hender og føtter, søvnforstyrrelser og impotens kan forekomme, og begrenser bruken av betablokkere i migrenebehandling (tabell 2).
Amitriptylin er det eneste trisykliske antidepressivum som har dokumentert effekt på episodisk migrene (25). Doseringsspennet er stort og må individualiseres. For pasienter med komorbiditet (depresjon, nevropatiske smerter) kan det være nødvendig med høyere doser. Amitriptylin er sederende og bør doseres på kvelden. Studiene som ligger til grunn for bruk av amitriptylin er eldre, men lang klinisk erfaring med legemidlet gjør at amitriptylin likevel er et av førstevalgene blant migreneforebyggende legemidler (25, 28).
Venlafaksin er et antidepressivum av klassen serotonin-noradrenalin-reopptakshemmer (SNRI) som har en mer gunstig sikkerhetsprofil enn amitriptylin. Legemidlet viser forebyggende effekt tilsvarende som for amitriptylin i noen studier (30), men det foreligger mindre klinisk erfaring. På grunn av en mindre sederende effekt kan venlafaksin være bedre for noen pasienter.
Dokumentasjonsgrunnlaget er svakere for kandesartan enn for betablokkere. En gunstig sikkerhetsprofil gjør likevel at kandesartan trekkes frem som et av førstevalgene. Studier for å sikre bedre dokumentasjonsgrunnlag pågår. For lisinopril er datagrunnlaget betydelig tynnere. Både kandesartan og lisinopril er teratogene og bør unngås hos pasienter med graviditetsønske (26).
Andre forebyggende legemidler
For valproat er kunnskapsgrunnlaget godt, men bivirkningsprofilen gjør at anbefalingen er svak. Topiramat har godt kunnskapsgrunnlag. En sterk anbefaling skyldes at topiramat har godkjent indikasjon og refusjon. En betydelig bivirkningsproblematikk har ført til reduksjon i bruk de siste årene. Verken valproat eller topiramat skal brukes av kvinner i fertil alder på grunn av teratogenisitet (25, 28).
Verapamil er den kalsiumkanalblokkeren som har vært mest brukt tidligere, men data på effekt mangler. Verapamil anbefales derfor ikke lengre som migreneprofylakse i Norge. Flunarizin, en uselektiv kalsiumkanalblokker, har ikke markedsføringstillatelse i Norge, men har god dokumentasjon på effekt. Tilgjengelighet, men også bivirkningsprofil (inklusive depresjon, trøtthet, vektøkning) gjør at anbefalingen er svak for flunarizin (28).
Kalsitoningenrelatert peptid (CGRP)-hemmere
CGRP-hemmerne er en ny legemiddelklasse som den siste tiden har fått mye oppmerksomhet. CGRP er et signalmolekyl som bidrar til nociseptiv signalisering og vasodilatasjon (31). Det finnes to grupper av CGRP-hemmere; monoklonale antistoffer mot CGRP og småmolekylære CGRPreseptorantagonister (gepanter). Erenumab, fremanezumab, galkanezumab og eptinezumab er monoklonale antistoffer godkjent for bruk i Norge per september 2023. De tre førstnevnte fås som subkutane injeksjoner, og er kun indisert for forebygging av migrene. Omtrent 50 % av pasientene får en halvering i månedlige migreneanfall med disse medisinene, sammenliknet med 27 % for placebo (32). Legemidlene fremstår godt tolerert, men langtidssikkerhet er ennå ikke dokumentert. Legemidlene er svært kostbare og kommer av den grunn med relativt strenge kriterier for forskrivning på blå resept (33). Blant gepantene er det foreløpig kun rimegepant som er godkjent i Europa og tilgjengelig i Norge. Til forskjell fra de monoklonale antistoffene, er rimegepant indisert både for anfallsbehandling og forebygging av migrene, og administreres peroralt (34). Gepanter virker å være lite drivende for MOH (35). Rimegepant er foreløpig ikke refusjonsberettiget (36).
Botulinumtoksin
Botulinumtoksin type A (botoks) viser moderat reduksjon i antall hodepinedager ved kronisk migrene i en større studie (37). Virkningen er kompleks, men det antas at opptak av botoks i nerveceller forhindrer videreformidling av smertesignaler (38). Norske retningslinjer for botulinumtoksin-behandling av kronisk migrene forutsetter at minimum 2–3 forebyggende behandlinger er forsøkt først, og at hodepinefrekvens reduseres med minimum 30 % for fortsatt behandling (39).
KVINNER OG MIGRENE
Hver fjerde til femte kvinne mellom 20 og 50 år har migrene. Prevalensen av migrene er omtrent tre ganger høyere hos kvinner i fertil alder, sammenliknet med menn i tilsvarende aldersklasse. Årsaken er at migrenen er nært knyttet til kjønnshormoner. Det er vist at svingninger i østrogennivå kan trigge migrene. Svingningene kan komme av biologiske prosesser, som menstruasjon, graviditet og overgangsalder eller ved bruk av eksogene hormoner fra prevensjonsmidler eller ved in vitro-fertilisering (4).
Rene gestagenpreparater er førstevalg ved behov for prevensjonsmiddel hos kvinner med migrene, men kvinner med migrene uten aura kan også bruke kombinasjons-p-piller (28). Kvinner som bruker kombinasjons-p-piller og som får migrene ved bortfallsblødninger, anbefales å bruke p-pillen kontinuerlig for å tilstrebe mest mulig stabilt østrogennivå (28, 40).
Ved behov for behandling med menopausal hormonterapi og samtidig migrene, anbefales transdermal formulering med østrogen (i kombinasjon med gestagen for ikke-hysterektomerte). Dette skyldes at den transdermale formuleringen gir mer stabilt østrogennivå enn peroral formulering (40).
Ved graviditet stiger østrogennivået til et stabilt høyt nivå og de fleste opplever bedring i migrenen. I perioden rundt fødsel faller østrogennivået igjen og begynner å fluktuere, noe som gjør at mange opplever en forverring (40).
Gravide og ammende kan bruke triptaner dersom ikke-medikamentelle tiltak og tradisjonelle analgetika ikke har tilstrekkelig effekt. Paracetamol er førstevalg både for gravide og ammende. Dersom paracetamol ikke gir tilstrekkelig effekt, kan ammende også forsøke NSAID. Gravide bør kun bruke NSAID dersom legen har vurdert dette spesielt, men NSAID skal ikke brukes i tredje trimester (41).
Hvis mulig bør forebyggende behandling seponeres i forbindelse med planlagt svangerskap. Propranolol (betablokkere) er likevel førstevalg hvis behov for forebyggende behandling i svangerskap eller under amming. Angiotensin II (ATII)-blokkere, angiotensinkonverterende enzym (ACE)-hemmere, valproat og topiramat er kontraindisert i hele svangerskapet. Mens valproat og topiramat på generelt grunnlag bør unngås hos kvinner i fertil alder, kan amitriptylin og kandesartan brukes under amming. Det bør likevel utvises forsiktighet ved amming av nyfødte og premature barn (28).
BEHANDLING AV BARN
Forekomsten av migrene blant barn antas å være cirka 8 %, med 6 % blant gutter og 10 % blant jenter. Debutalderen er i snitt 7 år hos gutter og 11 år hos jenter, og forekomsten øker frem til puberteten (42–44).
Anfallsbehandling
Paracetamol og ibuprofen er anbefalte førstevalg som anfallsbehandling, men ved utilstrekkelig effekt kan triptaner forsøkes (45). Sumatriptan og zolmitriptan, begge i form av nesespray, er godkjent i Norge for bruk i aldersgruppen 12 til 17 år. For andre migrenemidler foreligger det mangelfull dokumentasjon på effekt og sikkerhet hos barn. Dersom utilstrekkelig effekt av triptaner alene kan kombinasjon med NSAID forsøkes. Barn over 12 år kan få sumatriptan på blå resept. Hos barn synes det enda tydeligere individuelle forskjeller på effekten av de enkelte triptaner, bytte av triptan hvis manglende effekt er derfor viktig (44–46).
Forebyggende behandling
Ikke-farmakologisk behandling er svært viktig, med fokus på faktorer som søvn, mat, drikke, fysisk aktivitet, skjermtid og psykososiale faktorer. Forebyggende behandling med legemidler er en spesialistoppgave, og aktuelle legemidler er propranolol, topiramat og kandesartan (42, 47).
GENERELLE BEHANDLINGSPRINSIPPER
Migrenepasienter bør føre en oversikt over sine plager for å kartlegge hyppighet og intensitet av anfall, legemiddelforbruk og effekten av igangsatt behandling. Oversikten kan føres i en kalender i en hodepinedagbok eller i en dertil egnet app. All hodepine skal føres i hodepinedagboken, ikke bare migreneanfallene. Dette bør være viktige verktøy for pasient og behandlende lege for valg av behandlingsstrategi og videre oppfølging (4, 48).
For oppfølging av behandlingsetterlevelse og eventuelt vurdering av legemiddeldosering er det nå mulig å måle serumkonsentrasjoner på de fleste av de legemidlene som brukes i forebyggende behandling av migrene (49). Det pågår forskningsprosjekter som prøver å belyse hvilken dosering og serumkonsentrasjon som er riktig for optimal behandlingseffekt (50).
I tillegg til farmakologisk behandling er det også et grunnleggende viktig behandlingsprinsipp at pasientene gis individuell opplæring om sin sykdom, med fokus på mestring av egen situasjon og ikke-farmakologiske tiltak både ved anfall og i forebygging (4, 48). Generelle livsstilsråd vedrørende regelmessighet, søvn og måltider er viktig, og noen av pasientene har nytte av å prøve å unngå utløsende faktorer. Det er vanligvis en fordel at pårørende involveres i opplæringen. Overdrevent fokus på anfallsutløsende faktorer kan redusere pasientens livskvalitet, ofte i større grad enn migreneanfallene (4, 51).
Migrene kan hos alle pasienter forandre seg gjennom livet, og ved endring i mønsteret bør alltid lege kontaktes. Dette for å kunne optimalisere behandlingen, og for å utelukke andre årsaker til hodepinen (4, 48).
Apotekfarmasøyter har en viktig rolle i å veilede om riktig legemiddelbruk ved migrene, for eksempel vedrørende dose, frekvens og tid mellom doser for håndkjøpspreparater. For triptaner er det viktig å informere når ny dose kan tas, og om maksdose per døgn. Farmasøyter kan også bidra til å påminne om korrekt administrering av nesespray og subkutane injeksjoner (tabell 1).
Farmasøyter kan i dialog med pasienten ved uthenting av legemidler på resept eller ved håndkjøp av analgetika oppdage pasienter som står i fare for legemiddeloverforbruk, eller som bør få råd om å kontakte sin lege for å vurdere endring i behandlingsopplegg.
FREMTIDSUTSIKTER
Det er flere nye behandlingsalternativer på trappene, og sannsynligvis vil vi i løpet av de neste årene ha flere nye migrenemidler markedsført i Norge. Lasmiditan er et nytt legemiddel med virkningsmekanisme som likner triptaner, men med en mer selektiv reseptorbinding (5HT1F). I teorien skal dette bety mindre risiko for kardiovaskulære bivirkninger. Legemidlet er foreløpig ikke tilgjengelig i Norge, men er tatt i bruk internasjonalt, og europeiske legemiddelmyndigheter (EMA) anbefaler å tillate markedsføring av legemidlet i Europa (52).
Sannsynligvis vil flere gepanter også dukke opp på det norske markedet. Andre gepanter (ubrogepant, atogepant og zavegepant) er allerede godkjent av Food and Drug Administration (FDA), og flere er under utvikling (10, 53). Disse utprøves for flere indikasjoner og i forskjellige formuleringer (eksempelvis zavegepant som nesespray). Oppgitte interessekonflikter: Artikkelforfatter Sigrid Grøttebø Hellem har byttet jobb siden publikasjonen ble skrevet.
Referenser
1. HUNT 4 (Head-HUNT). Totale prevalenstall for migrene. Knut Hagen, personlig meddelelse.
2. Steiner TJ, Stovner LJ, Jensen R et al. Migraine remains second among the world’s causes of disability, and first among young women: findings from GBD2019. J Headache Pain 2020; 21: 137.
3. World Health Organization and Lifting The Burden (2011). Atlas of headache disorders and resources in the world 2011. WHO, Geneva. www.who.int (Publisert: 2011).
4. Norsk Elektronisk Legehåndbok. Nevrologi. Migrene. https:// nevrologi.legehandboka.no/ (Sist oppdatert: 15. mars 2022).
5. Charles AC, Baca SM. Cortical spreading depression and migraine. Nat Rev Neurol 2013; 9: 637-44.
6. Headache Classification Committee of the International Headache Society (IHS). The International Classification of Headache Disorders, 3rd edition. Cephalalgia 2018; 38: 1–211.
7. Norsk Elektronisk Legehåndbok. Nevrologi. Medikamentoverforbukshodepine (MOH). https://nevrologi.legehandboka.no/ (Sist oppdatert: 1. november 2021).
8. Amundsen S, Pool ACB, Spigset O et al. Farmakologisk behandling av migrene. Norsk Farmaceutisk Tidsskrift 2015; 11: 30–5.
9. Healthcare Improvement Scotland. SIGN 155 – Pharmacological management of migraine; A national clinical guideline. SIGN migraine guideline | SIGN guideline | Guidelines (Publisert februar 2018).
10. Schwedt TJ, Garza I. Acute treatment of migraine in adults. Version 88.0. In: UpToDate. www.helsebiblioteket.no/ (Sist oppdatert: 10. mai 2022).
11. Becker WJ. Acute Migraine Treatment in Adults. Headache 2015; 55: 778–93.
12. Evers S, Afra J, Frese A et al. European Federation of Neurological Societies. EFNS guideline on the drug treatment of migraine–revised report of an EFNS task force. Eur J Neurol 2009; 16: 968–81.
13. Lipton RB, Diener HC, Robbins MS et al. Caffeine in the management of patients with headache. J Headache Pain 2017; 18: 107.
14. Derry CJ, Derry S et al. Caffeine as an analgesic adjuvant for acute pain in adults. Cochrane Database Syst Rev 2014; 2014: CD009281.
15. Marmura MJ, Silberstein SD, Schwedt TJ. The acute treatment of migraine in adults: the american headache society evidence assessment of migraine pharmacotherapies. Headache 2015; 55: 3–20.
16. VanderPluym JH, Halker Singh RB, Urtecho M et al. Acute Treatments for Episodic Migraine in Adults: A Systematic Review and Meta-analysis. JAMA 2021; 325: 2357–69.
17. Laurell K, Artto V, Bendtsen L et al. Migrainous infarction: a Nordic multicenter study. Eur J Neurol 2011; 18: 1220–6.
18. Pringsheim T, Becker W J. Triptans for symptomatic treatment of migraine headache BMJ 2014; 348: 2285.
19. Kelley NE, Tepper DE. Rescue therapy for acute migraine, part 2: neuroleptics, antihistamines, and others. Headache 2012; 52: 292–306.
20. Garza I, Schwedt TJ. Medication overuse headache: etiology, clinical features, and diagnosis. Version 20.0 In: UpToDate. www. helsebiblioteket.no (Sist oppdatert: 15. november 2021).
21. Diener HC, Antonaci F, Braschinsky M et al. European Academy of Neurology guideline on the management of medication-overuse headache. Eur J Neurol 2020; 27: 1102–16.
22. Carlsen LN, Munksgaard SB, Nielsen M et al. Comparison of 3 Treatment Strategies for Medication Overuse Headache: A Randomized Clinical Trial. JAMA Neurol 2020; 77: 1069–78.
23. Kristoffersen ES. Personlig meddelelse.
24. Kristoffersen ES, Lundqvist C. Medication-overuse headache: epidemiology, diagnosis and treatment. Ther Adv Drug Saf 2014; 5: 87–99.
25. Schwedt TJ, Garza I. Preventive treatment of episodic migraine in adults. Version 87.0 In: UpToDate. www.helsebiblioteket.no (Sist oppdatert: 4. april 2023).
26. Kumar A, Kadian R. Migraine Prophylaxis. [Updated 2022 Sep 9]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; Jan 2022. (Sist oppdatert: 9. september 2022).
27. Sprenger T, Viana M, Tassorelli C. Current Prophylactic Medications for Migraine and Their Potential Mechanisms of Action. Neurotherapeutics 2018; 15: 313–23.
28. KUPP – Kunnskapsbaserte oppdateringsvisitter. Riktigere bruk av legemidler mot migrene. https://legemidler.no/kampanjer/ (Publisert: august 2022).
29. Silberstein SD, Holland S, Freitag F et al. Quality Standards Subcommittee of the American Academy of Neurology and the American Headache Society. Evidence-based guideline update: pharmacologic treatment for episodic migraine prevention in adults: report of the Quality Standards Subcommittee of the American Academy of Neurology and the American Headache Society. Neurology 2012; 78: 1337–45. Erratum in: Neurology 2013; 80: 871.
30. Hedayat M, Nazarbaghi S, Heidari M et al. Venlafaxine can reduce the migraine attacks as well as amitriptyline: A noninferiority randomized trial. Clin Neurol Neurosurg 2022; 214: 107151.
31. Norsk legemiddelhåndbok for helsepersonell. Midler ved migrene. http://legemiddelhandboka.no/ (Sist oppdatert: 11. juni 2020).
32. Loder EW, Robbins MS. Monoclonal Antibodies for Migraine Prevention: Progress, but Not a Panacea. JAMA 2018; 319: 1985–7.
33. HELFO. Individuell stønad til Aimovig, Ajovy og Emgality. www. helfo.no (Sist oppdatert: 22. april 2022).
34. Statens legemiddelverk. Preparatomtale (SPC) Vydura. www. legemiddelsok.no/ (Sist oppdatert: 3. oktober 2022).
35. Lo Castro F, Guerzoni S, Pellesi L. Safety and Risk of Medication Overuse Headache in Lasmiditan and Second-Generation Gepants: A Rapid Review. Drug Healthc Patient Saf 2021; 13: 233–40.
36. Norvik M, Hellem SG. Gepanter – nye legemidler mot migrene. Norsk Farmaceutisk Tidsskrift 2022; 7: 38.
37. Aurora SK, Dodick DW Diener HC et al. OnabotulinumtoxinA for chronic migraine: efficacy, safety, and tolerability in patients who received all five treatment cycles in the PREEMPT clinical program. Acta Neurol Scand 2014; 129: 61–70.
38. Ramachandran R, Yaksh TL. Therapeutic use of botulinum toxin in migraine: mechanisms of action. Br J Pharmacol 2014; 171: 4177–92.
39. Norsk Elektronisk Legehåndbok. Nevrologi. Retningslinjer for Botox-behandling ved kronisk migrene. https://nevrologi.legehandboka.no/ (Sist oppdatert: 6. juni 2018).
40. Sacco S, Ricci S, Degan D et al. Migraine in women: the role of hormones and their impact on vascular diseases. J Headache Pain 2012; 13: 177–89.
41. Myhr R, Havnen GC et al. Gravide og ammende kan bruke triptaner. www.relis.no/ (Publisert: 25. august 2017).
42. Norsk Elektronisk Legehåndbok. Pediatri. Migrene hos barn og unge. https://nevrologi.legehandboka.no/ (Sist oppdatert: 6. april 2022)
43. BMJ Best Practice. Migraine headache in children. (Sist oppdatert 7. juli 2020).
44. Gelfand AA. Pathophysiology, clinical features, and diagnosis of migraine in children.Version 35.0.In: UpTo Date. https://helsebibioteket.no (Sist oppdatert: 31. januar 2023).
45. Mack KJ. Acute treatment of migraine in children. Version 44.0. In: UpToDate. https://helsebibioteket.no (Sist oppdatert: 1. januar 2022).
46. Tessem GAG. Personlig meddelelse.
47. Mack KJ. Prventive treatment of migraine in children. Version 26.0. In: UpToDate. https://helsebibioteket.no (Sist oppdatert: 1. april 2022).
48. BMJ Best Practice. Migraine headache in adults. (Sist oppdatert 14. oktober 2022).
49. Farmakologiportalen – Substanser. www.farmakologiportalen. no/substances
50. NorHEAD – MigriNor. Forbedring av forebyggende behandling mot migrene – St. Olavs hospital (stolav.no).
51. Martinelli D, Pocora MM, De Icco R et al. Triggers of migraine: where do we stand? Curr Opin Neurol 2022; 35: 360–6.
52. European Medicines Agency. Human medicine European public assessment report (EPAR): Rayvow. (Publisert: 3. oktober 2022).
53. Moreno-Ajona D, Villar-Martínez MD, Goadsby PJ. New Generation Gepants: Migraine Acute and Preventive Medications. J Clin Med 2022; 11: 1656.
Forfattere
