Ketamin vid depression och kiralitet – som hand i handske?
Introduktion
Ketamin har rapporterats ge en snabb men kortvarig effekt mot depressiva symtom, inte minst på grund av dess mycket snabbare och mer dramatiska effekt än konventionella antidepressiva läkemedel. Eftersom ketamin också har en missbrukspotential har detta varit föremål för stort intresse med motstridiga åsikter.
Den ena av ketamins enantiomerer, (S)-ketamin, är i en beredning som nässpray godkänd för behandling av depression i både USA och Europa. Djurstudier har visat en möjlig bättre effekt av (R)-formen och en farmakokinetisk interaktion mellan de två formerna som leder till en förlängd effektduration av racematet.
Ketamins kiralitet och dess möjliga betydelse diskuteras därför i denna artikel.
Kiralitet
Större molekyler kan i en två- eller tredimensionell presentation ha olika strukturformler trots att de har samma summaformel. Detta fenomen kallas för isomeri.
Inom isomerin finns det olika varianter, bl.a. den sk spatiala isomerin eller stereoisomerin, där skillnaderna först syns vid en tredimensionell presentation av formeln. Inom stereoisomerin finns sedan som specialfall kiraliteten; kirala molekyler har minst en (ofta kol-)atom med fyra olika ligander. Med detta finns det två olika former för denna del av molekylen som är spegelvända mot varandra. Atomen i centrum med dessa fyra ligander kallas för ett kiralt eller stereocentrum och de två resulterande molekyler för enantiomera. Om man har en blandning med lika stora andelar av de två former så kallas blandningen för ett racemat (eller racemisk blandning).
Kiralitet har betydelse för molekylens och den resulterande substansens egenskaper. Ett exempel är aminosyran asparaginsyra, där bara en av enantiomererna smakar sött, medan den andra är smaklös (1). I biokemin kan enzym inte sällan bara hantera en av de två formerna och i interaktion med receptorer passar ofta (men inte alltid) bara en av formerna; ofta finns det en skillnad i affinitet mellan de två formerna. Detta kan leda till olika farmakologiska effekter av de två enantiomera och även till att en av formerna bryts ner eller elimineras snabbare än den andra.
Kiralitet och nomenklatur
För att beskriva kiralitet har det funnits olika system. Tre system (+/-, D/L och R/S-system) beskrivs här. Dessa tre system är inte relaterade till varandra; en kategorisering i ett av systemen ger ingen kunskap om vilken kategori formen tillhör i något av de andra två systemen.
Mätning av optisk aktivitet (+/- och d/l)
Äldst är systemet som beskriver hur dessa substanser påverkar rotationen av polariserat ljus. En lösning med bara en av enantiomera förändrar rotationsplanet av ljuset, vilket kan observeras med ett polarisationsfilter. Beroende på åt vilket håll planet vrids vid genomgång genom lösningen med substansen benämns enantiomera. Vrids ljuset åt höger (medsols), så benämns formen som +-formen (alt d-formen för dextrorotatory, högervridning), vrids den åt vänster (motsols) som –formen (alt l-formen för levorotatory, vänstervridning). Benämning med d och l bör undvikas p.g.a. risk för förväxling med D/L-systemet (se nedan). Viktigt för tolkningen är att observera om det är små eller stora bokstäver. Eftersom samma enantiomer kan påverka polariserat ljus på olika sätt beroende på till exempel pH-värdet, sker benämning under definierade omständigheter. Systemet används inte längre för nya benämningar, men kan hittas i äldre litteratur eller hos vissa substanser (till exempel dexamfetamin, som är d-amfetamin).
D/L-systemet (Fischer-nomenklatur)
D/L-systemet anger en relativ konfiguration och bestäms (se bilden ovan) genom att man ritar en molekyl med flera kolatomer enligt Fischer-projektionens regler med kolatomskedjan uppifrån och ner. Kolatomen som har lägst ordningsnummer enligt IUPACs regler ritas längst upp. Sedan tilldelar man liganderna på det kirala centret längst ner i kedjan varsin prioritet och vänder molekylen så att kolkedjan (R i bilden) ligger bakom bildytan och de horisontella liganderna ligger framför. Pekar liganden med den högre prioriteten (aminogruppen i bilden ovan) till vänster, benämns formen som L-enantiomer (laevis, latin för vänster), pekar den till höger benämns enantiomeren som D-enantiomer (dexter, latin för höger).
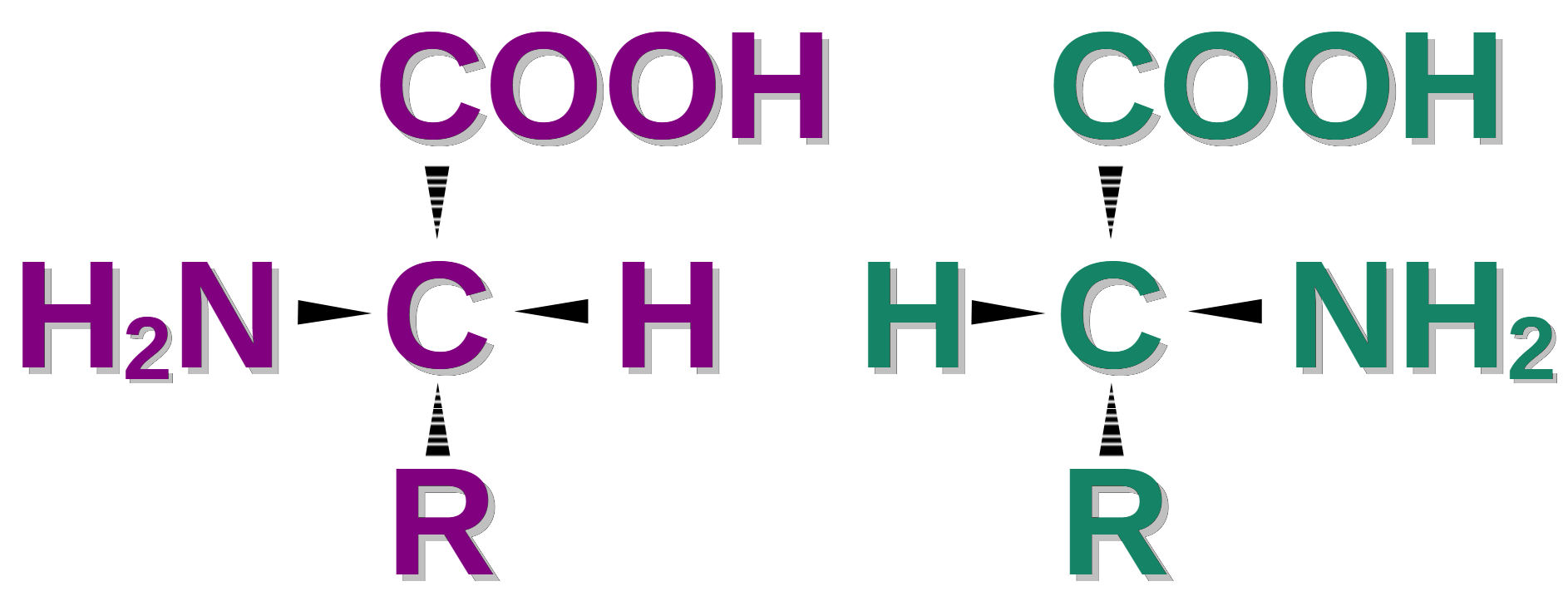
Tyvärr är indelningen inte entydig; för t.ex. vinsyra kan samma enantiomer benämnas som D- eller L-enantiomer (John D. Roberts & Marjorie C. Caserio, 2014a). Nomenklaturen används i dag oftast i samband med aminosyror eller olika sockermolekyler. D och L skrivs som små kapitäler, dvs stora bokstäver med mindre fontstorlek. Man ska inte skriva med små bokstäver (d och l) för då finns det stor risk för förväxling med +/–systemet, där d och l har använts som alternativ till + och -.
Referenser:
Roberts JD, Caserio MC. The D, L Convention for Designating Stereochemical Configurations & Absolute And Relative Configuration. In: Basic Principles of Organic Chemistry. https://chem.libretexts.org/Bookshelves/Organic_Chemistry
R/S-systemet (Cahn–Ingold–Prelog-systemet (CIP))
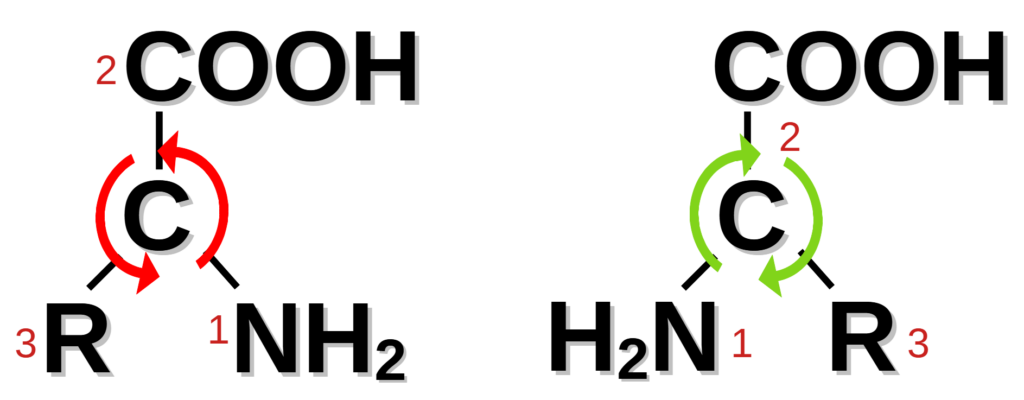
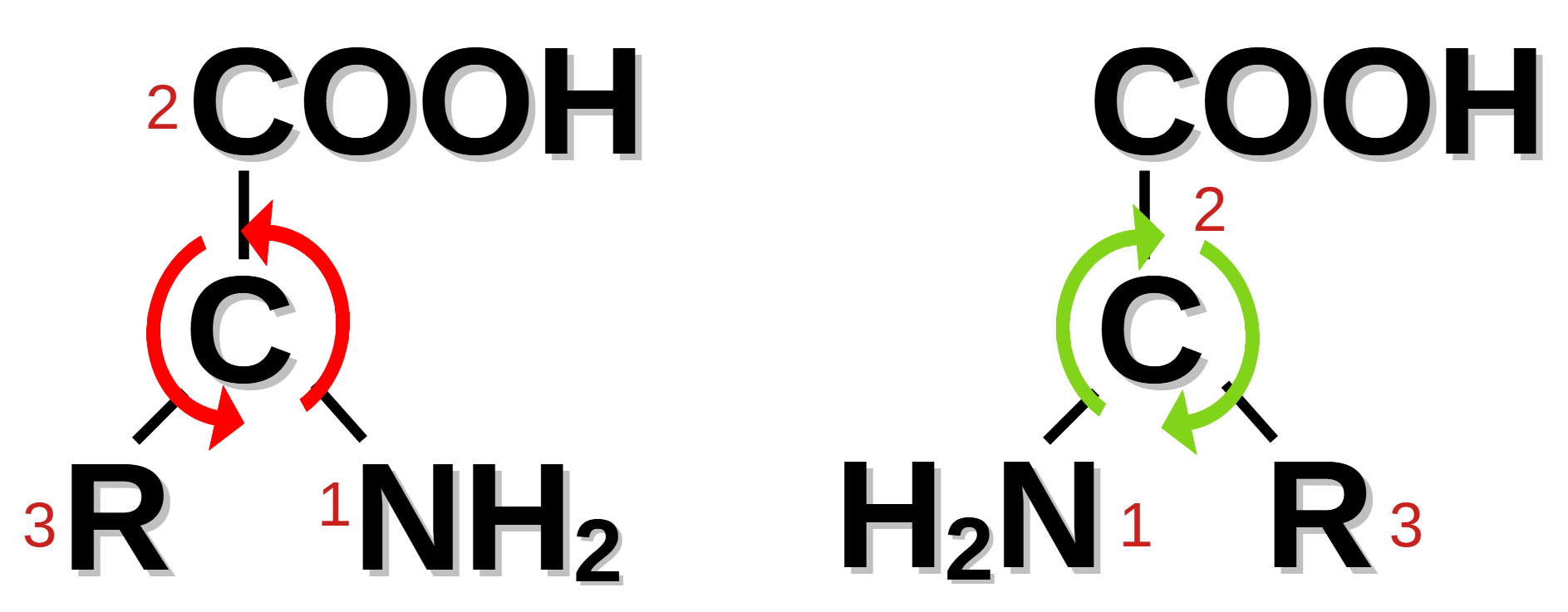
Det mest moderna systemet, som dessutom, i motsats till de andra två, beskriver en absolut konfiguration. Här tillskrivs varje direkt ligand en prioritet som utgår från dess atomnummer. Om två direkta ligander har samma atomnummer så används nästa atom som är bunden till dem för jämförelsen. Liganden med lägst prioritet vänds sedan bort från betraktaren och är gömt bakom kolatomen i bilden ovan; om man sedan går från liganden med högst prioritet till lägst, så leder det till att riktningen blir antingen med- eller motsols (se pilarna i bilden). Om den är medsols, så föreligger en (R)-form (från latin rectus, höger, rak eller rätt), om följden är motsols föreligger en (S)-form (från latin sinister, vänster). R eller S skrivs i regel kursivt och i parentes; i vissa fall används prefixet es- (för (S)-formen) och ar- (för (R)-formen) istället, framförallt när det gäller läkemedelsnamn (till exempel esketamin, som korrekt är (S)-ketamin).
Ketamin
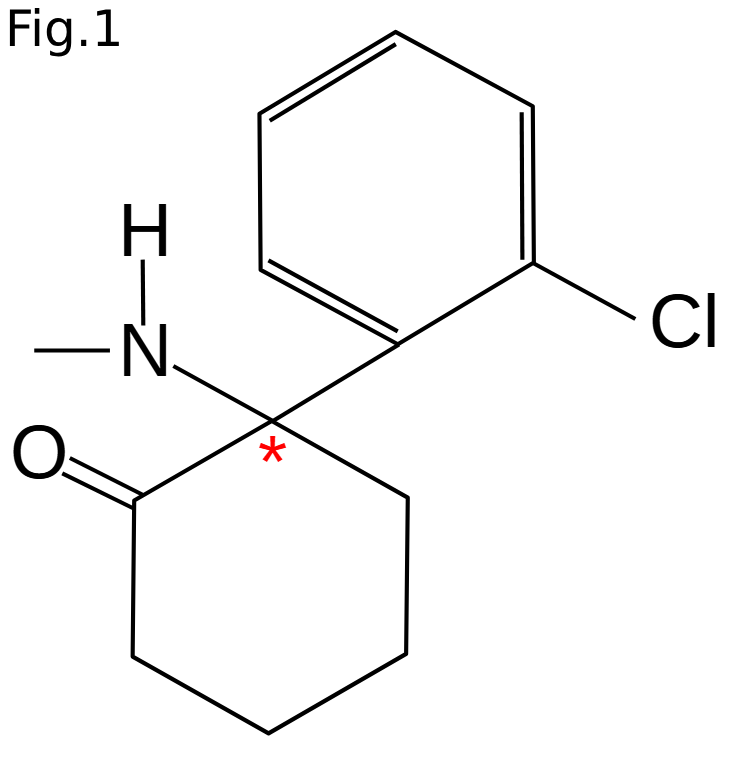 Ketamin introducerades som CI-581 och tillverkades i början som ett fencyklidin (PCP)-derivat (2). PCP hade under en kort tid använts som anestetikum, men hade p.g.a. biverkningar dragits in 1965. Molekylen för ketamin (2-(2-chlorophenyl)-2-(methylamino)cyclohexan-1-one) har ett kiralt centrum. I bilden (fig. 1) visas formeln med det kirala centret markerat med en röd stjärna (*).
Ketamin introducerades som CI-581 och tillverkades i början som ett fencyklidin (PCP)-derivat (2). PCP hade under en kort tid använts som anestetikum, men hade p.g.a. biverkningar dragits in 1965. Molekylen för ketamin (2-(2-chlorophenyl)-2-(methylamino)cyclohexan-1-one) har ett kiralt centrum. I bilden (fig. 1) visas formeln med det kirala centret markerat med en röd stjärna (*).
Ketamin används som så kallat dissociativt anestetikum; ordet dissociativt relaterar till en dissociation mellan aktiviteten i de centrala delarna av hjärnan och kortikala arealer (hjärnbarken) med en ökad aktivitet i de förstnämnda och mycket långsam synkron aktivitet i de sistnämnda områden, dock utan en spridning av dessa nästan epileptiforma potentialer till andra delar av hjärnan (2-4).
Redan vid de tidigaste studier noterade man egenskaper som tydligt avvek från de tidigare kända narkosläkemedlen (2, 4):
• hyperaktiva reflexer under narkosen
• en analgesi redan under subnarkotiska doser
• ökning av blodtrycket via en centralnervös sympatomimetisk effekt och samtidigt, om den blockerades, en blodtryckssänkning via perifera vasodilatatoriska och kardiodepressiva effekter
• frånvaro av andningshämmande effekter
• ”vivid dreamlike experiences or frank hallucinations” som upplevdes av mellan 5-30% av försökspersonerna, men som i regel avtog inom en till två timmar
Risken för hallucinationer eller beteendeavvikelser ökade med dosen, infusionshastigheten, ålder och kön (högre för kvinnor) (2).
Farmakokinetik
Metabolism och metaboliter
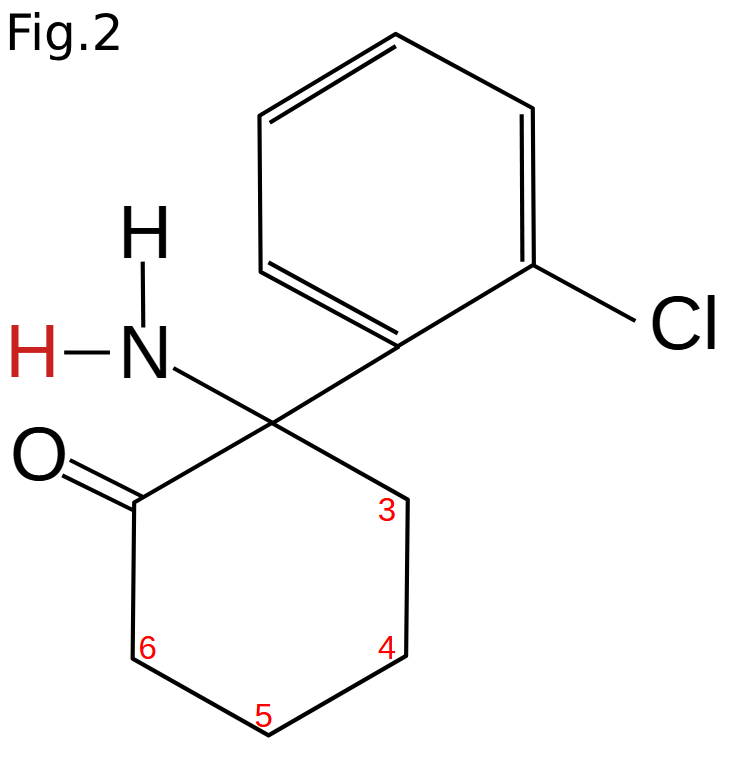 Ketamin metaboliseras, huvudsakligen genom en N-demetylering till respektive norketamin (fig. 2) sannolikt via CYP3A4; även CYP2B6, CYP2C9, CYP2C19 och CYP2D6 har visats bidra till denna metabolismsteg (5). För CYP2B6 har genetiska varianter hittats som leder till förändrad clearance av ketamin (6). Norketamin metaboliseras sedan vidare till olika varianter av hydroxynorketamin (HNK), där hydroxygruppen både kan sitta på olika kolatomer (position 3, 4, 5 och 6, utmärkt i fig. 2) och – eftersom detta genererar ytterligare ett stereocentrum – där det kan finnas två olika stereoisomera per position (7).
Ketamin metaboliseras, huvudsakligen genom en N-demetylering till respektive norketamin (fig. 2) sannolikt via CYP3A4; även CYP2B6, CYP2C9, CYP2C19 och CYP2D6 har visats bidra till denna metabolismsteg (5). För CYP2B6 har genetiska varianter hittats som leder till förändrad clearance av ketamin (6). Norketamin metaboliseras sedan vidare till olika varianter av hydroxynorketamin (HNK), där hydroxygruppen både kan sitta på olika kolatomer (position 3, 4, 5 och 6, utmärkt i fig. 2) och – eftersom detta genererar ytterligare ett stereocentrum – där det kan finnas två olika stereoisomera per position (7).
Bara en liten del av dosen elimineras som antingen oförändrad ketamin (2%) eller norketamin (2%); istället hittas bland annat en rad glukuronider av de olika metaboliter i urinen, där ca 91% av substansen kan återfinnas inom loppet av fem dagar. Ketamin inducerar in vitro en rad av enzym som är involverade i dess metabolism (autoinduktion) (8, 9) och hämmar metabolismen av bland annat morfin till dess inaktiva 3-glukuronid. Detta kan bidra till en förstärkt effekt av morfin när dessa två läkemedlen kombineras (4, 10, 11). Denna effekt används till exempel vid behandling av allvarliga smärttillstånd i samband med cancer (12).
Ketamins (racematets) halveringstid i plasma anges med 2-4 timmar (13).
Ketamins kiralitet
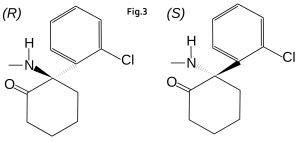 Ketamin, som används för narkosändamål, föreligger som racemat (fig. 3) (14). Läkemedel innehållande ketamin som marknadsförs för behandling av depression innehåller i dag (S)-ketamin (14-16), men många av de initiala studier avseende ketamins effekt på depressioner är gjorda på racematet (17, 18).
Ketamin, som används för narkosändamål, föreligger som racemat (fig. 3) (14). Läkemedel innehållande ketamin som marknadsförs för behandling av depression innehåller i dag (S)-ketamin (14-16), men många av de initiala studier avseende ketamins effekt på depressioner är gjorda på racematet (17, 18).
Farmakokinetiska konsekvenser
En in vitro-studie undersökte ketamins (racematets) metabolism via olika CYP-enzymer och fann att CYP2B6 och CYP3A4 bidrog mest till ketamins N-demetylering. Det syntes en tydlig enantiomerselektivitet när metabolismen via CYP3A4 undersöktes med en mycket snabbare metabolism av (S)-ketamin jämfört med (R)-ketamin (19).
En studie med friska manliga försökspersoner (n=10) visade att clearance av (S)-ketamin var högre än av racematet och av (R)-ketamin; dessutom visade studien att clearance av (S)-ketamin var högre i den rena isomeren än i racematet; slutsatsen var att (R)-ketamin hämmar elimination av (S)-ketamin (20).
I konsekvens innebär det att man kan förvänta sig en kortare effekttid vid användning av (S)-ketamin än vid användning av racematet, om den antidepressiva effekten påverkas av framför allt koncentrationsförloppet av (S)-ketamin eller summan av båda substanserna (active moiety).
Farmakodynamiska konsekvenser
Ganska snart efter att de psykotropa effekter av racematet upptäcktes började undersökningen av vilka effekter som kunde tillskrivas vilken enantiomer.
En PET-studie med tio deltagare fann att psykotiska symptom (depersonalisation, hallucinationer) som tidigare hade beskrivits, flacka affekter och en hyperacusis med påverkan på deltagarnas tankeinnehåll och deras inre upplevelse uppträdde vid användning av (S)-, men inte av (R)-formen; under infusion av (R)-formen beskrev en del deltagare en upplevelse av avslappning, som ledde till en icke-signifikant signal i de använda instrumenten. Dessutom fanns det i PET-undersökningen en skillnad avseende metabol omsättning av glukos, där man under infusionen av (S)-ketamin kunde se en kortikal och frontal betonad ökning av glukosomsättning, medan man under infusion med (R)-formen såg en minskning av omsättningen framförallt i temporomedial cortex och vänstra insula. (21)
Samtidigt verkar (S)-ketamin ha en högre anestetisk potens, en högre clearance med en snabbare återhämtning efter narkosen (22) och medföra en högre risk för psykotiska upplevelser (23).
Interaktion med målproteiner
Ketamin har rapporterats att interagera med många receptorer (23-26):
N-methyl-D-aspartate (NMDA) receptorer
NMDA-receptorer (NMDAR) är jonotropa ligandstyrda glutamaterga receptorer som är sammansatta av fyra proteinsubenheter. Tre olika typer av subenheter finns (GluN1-3); i typiska fall består en NMDA-receptor av två GluN1-subenheter tillsammans med GluN2- eller GluN3-subenheter. Varje subenhet kan föreligga i olika varianter genom alternativ splicing för GluN1 (åtta varianter) och fyra olika gener för GluN2 (GluN2A-D) och fyra olika gener för GluN3 (GluN3A och GluN3B). (7, 27).
Denna mångfald leder till en stor variabilitet i funktion och effekt. Framförallt (S)-ketamin agerar som antagonist på NMDAR och ett antal hypoteser avseende verkningsmekanismer bakom dess antidepressiva effekt har formulerats; dessa implicerar en större effekt av (S)-ketamin. De två viktigaste är:
- Disinhibitionshypotesen utgår från att det är en subpopulation av NMDAR som påverkas och som sitter presynaptiskt på GABAerga interneuroner. Genom att hämma (!) utsöndringen av GABA disinhiberas postsynaptiska glutamaterga neuroner, vilket leder till en ökad glutamaterg transmission. Den ökade glutamaterga transmissionen i sin tur påverkar andra system, t.ex. BDNF (brain derived neurotrophic factor), vascular endothelial growth factor (VEGF) och insulin-like growth factor 1 (IGF-1). (28)
- Inhibition av spontan NMDAR-medierad transmission: denna hypotes utgår från att en kontinuerlig spontan glutamaterg transmission leder via NMDAR-aktivering till en hämning av proteinsyntesen; en hämning av NMDAR leder med detta till en ökad proteinsyntes av proteiner med betydelse för depressivt beteende.
Ytterligare en del hypoteser handlar om förändrad produktion av proteiner med känd eller förväntad effekt på depression (Eukaryotic elongation factor 2 kinase (eEF2K), Brain-derived neurotrophic factor (BDNF)) och indirekt påverkan på t.ex. mechanistic target of rapamycin (mTOR) som konsekvens av NMDAR-hämningen. Dessa teorier talar för (S)-ketamins användning pga dess högre affinitet till receptorn; BDNFs betydelse styrks av att en variant i genens prodomain-del påverkar effekten av behandling med ketamin. (29)
Samtidigt kan man inte nå en motsvarande antidepressiv effekt med andra NMDAR-antagonister som PCP eller memantin (30-32).
α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid (AMPA) receptorer
För två metaboliter, (2R,6R)-hydroxynorketamin ((2R,6R)-HNK), som är en metabolit av (R)-ketamin och i mindre utsträckning (2S,6S)-HNK), har man kunnat visa interaktioner med receptorer (mTOR, AMPAR (33, 34)) och i djurförsök effekt på depressionsmodell (33). I vilken utsträckning dessa molekyler bidrar till den kliniska effekten hos människan är dock ännu oklar.
Sigma-receptorer
(R)-ketamin interagerar med en högre affinitet (IC50 ~15-19µM) än (S)-ketamin (IC50 100-131 µM) med sigma-receptorer och där framförallt med sigma2-receptorer; aktivering av dessa receptorer har associerats med antidepressiva effekter (16, 25, 26, 34).
My-opioid-receptorer
My-opioid-receptorer (MOR) är en grupp av tre GPCR som interagerar med endogena och tillförda opioider; MOR1 associeras mest med analgesin och beroendeeffekten, MOR2 med eufori, andningsdepression, förstoppning och beroenderisken och MOR3 med vasodilatation (35). (S)-ketamin binder til MOR ved lägre konsentrationer än (R)-ketamin (16).
Användning och indikation
År 2000 publicerade Berman och kollegor en studie, där sju patienter med svår depression behandlades med 0,5 mg/kg racemisk ketamin intravenöst. Studien fann minskade poäng på Hamilton Depression Rating Scale (HDRS) 72 timmar efter injektionen. Utifrån dessa fynd drogs slutsatsen att NMDAR-modulerande medel kan ha en roll i behandlingen av depression (36, 37).
Mest uppseendeväckande var den relativt snabba antidepressiva effekten. Ketamin har därefter i olika formuleringar, isomera former och administreringsvägar varit föremål för studier som behandling för egentlig depression (MDD), behandlingsresistent depression, bipolär sjukdom, självmordstankar och ångest.
De flesta studier har genomförts på patienter med behandlingsresistent depression. I detta sammanhang definieras behandlingsresistent depression oftast som klinisk depression som inte har svarat på minst två olika behandlingar med antidepressiva läkemedel i en måttlig till svår depressiv episod. Detta är även definitionen i den godkända indikationen för (S)-ketamin nässpray (38, 39).
Skulle ketamin visar sig vara en effektiv behandling för MDD, behandlingsresistent depression, bipolär sjukdom, självmordstankar eller ångest, kan den snabbt insättande effekten bidra till att lösa en svårighet med dagens antidepressiva behandling, där effektstorleken för läkemedel generellt är lägre (40- 42) och tar längre tid att utvecklas fullt ut. Detta stämmer även för icke-farmakologiska behandlingsformer som psykoterapi (med undantag för ECT) för depressiva sjukdomar.
Både effekter och biverkningar av ketamin är dosberoende. Både racemat och (S)-ketamin ger ett snabbt svar (timmar-dagar) med återfall (dagar-veckor) både efter engångsbehandling och efter upprepad dosering. Regimer som har studerats är dosering 1-3 gånger i veckan med längre intervall efter fyra veckor (43). Liknande observationer som för behandlingsresistent depression har setts vid behandling av MDD (44). Dokumentationen för effekten av racemisk ketamin och intranasal (S)-ketamin vid bipolär sjukdom är betydligt mindre (45), och en effekt mot självmordstankar hos patienter med behandlingsresistent depression har föreslagits, men inte kunnat visas (46).
Nackdelar förknippade med behandling med ketamin är biverkningar inklusive dissociation, men även praktiska aspekter som att fastställa rätt dos, val av administreringssätt och behandlingslängd plus säkerheten under behandlingen över tid. Även om racemiskt ketamin är ett billigt läkemedel leder behovet av administrering under övervakning att användning av ketamin blir en resurskrävande och relativt dyr behandling.
Det finns många publikationer om ketamin i olika former vid behandling av depression och andra psykiska tillstånd. Flera studiegrupper är representerade med ett betydande antal artiklar, delvis med varierande författarordning. Nackdelar som framhållits i de flesta publikationer hittills är att de flesta studier har mycket få deltagare och ofta har svag metodologisk design. Ett betydande problem är att behandlingen är svår att blinda, särskilt jämfört med placebo, på grund av dissociation. I vissa fall har midazolam prövats som jämförelsemedel för att övervinna detta (44).
Dessa svårigheter illustreras till exempel i en jämförande observationsstudie av ketamin intravenöst kontra (S)-ketamin intranasalt mot behandlingsresistent depression (n=62). Ungefär hälften av patienterna i studien samtidigt behandlades med olika andra psykofarmaka inklusive SSRI, SNRI, TCA, bensodiazepiner eller atypiska antipsykotika, i genomsnitt tre läkemedel per patient. Behandling med ECT (40%) och TMS (transkraniell magnetstimulering) förekom också. Utöver detta hade patienterna komorbiditeter som ångest (>60%), PTSD (10%), fibromyalgi eller kronisk smärta och >10% hade samtidigt ett missbruksproblem (47).
Olika komplexa behandlingar och olika diagnoskombinationer gör det svårt att dra generella slutsatser vilken del av effektskillnaden ligger i de olika beredningar och administrationssätt.
Ketamin finns i olika beredningar. Biotillgängligheten av substansen är högst vid intravenös administration och minskar sedan stegvis från intramuskulärt, subkutant, intranasal till oralt (48). Intranasalt är biotillgängligheten av ketamin cirka 30-50%, vilket innebär att den administrerade dosen i mg måste vara relativt sett större än vid intravenös administrering för att uppnå samma koncentration. Oralt har ketamin en biotillgänglighet på 10-20% och first-pass metabolism resulterar i en effektfördröjning på 15-30 minuter jämfört med intranasal administrering (49).
Föreslagen dosering
Racemisk ketamin intravenöst: 0,5 (0,1-1,0) mg/kg, eventuellt justerat enligt idealvikt för överviktiga personer, över 40 minuter med en observationstid på minst två timmar. En engångsdos har visat effekt på behandlingsresistent depression i 3-7 dagar, en upprepad dosering i 2-3 veckor. Det saknas studier om långtids- eller underhållsbehandling. De flesta patienter återfaller inom en månad (48).
(S)-ketamin intranasalt: 56 mg (två nässpraybehållare) två gånger i veckan titreras till 56-84 mg/vecka under fyra veckor. Med denna dos behandlas patienten varje vecka i fyra veckor och underhållsbehandlingen sker med 56-84 mg var till varannan vecka. Underhållsbehandling har studerats i upp till ett år (48). Den godkända produktresumén (SPC) av Spravato kräver blodtrycksmätning efter cirka 40 minuter, men längre uppföljningstid efter administrering bör övervägas (38, 39).
(S)-ketamin nässpray har något mer systematisk och riktad dokumentation vid behandlingsresistent depression än intravenös ketamin. Detta kan i alla fall delvis bero på att ketamin är generiskt tillgängligt för anestesi, medan (S)-ketamin nässpray är patenterad och därför nyligen har genomgått nödvändiga kliniska studier för godkännande som tilläggsbehandling för behandlingsresistent depression (48). En systematisk översikt och metaanalys fann ändå att intravenöst racemiskt ketamin hade både bättre effekt och färre biverkningar vid behandlingsresistent depression än intranasal (S)-ketamin (43). En observationell studie har funnit att intravenöst racemiskt ketamin kräver färre behandlingar än intranasal (S)-ketamin för att uppnå remission (47).
En annan systematisk översikt och metaanalys som inkluderade ketamin och (S)-ketamin vid MDD, behandlingsresistent depression, bipolär sjukdom och självmordstankar drar slutsatsen att kvaliteten och storleken på tillgängliga studier huvudsakligen är mycket låg och heterogen, och bra data om effekt och säkerheten för långtidsbehandling saknas, så det är svårt att dra säkra slutsatser (50).
(R)-ketamin
2021 genomförde Leal och kollegor en öppen pilotstudie där sju patienter med behandlingsresistent depression fick en infusion av (R)-ketamin 0,5 mg/kg och författarna rapporterade en signifikant minskning av Montgomery-Åsberg Depression Rating Scale (MADRS) poäng efter en dag, uppenbarligen utan förekomst av dissociation hos patienterna (51). Samma studiegrupp fann å andra sidan ingen skillnad mot placebo i en randomiserad, dubbelblind crossover-studie på 10 patienter med behandlingsresistent depression (52).
I en annan öppen pilotstudie fann studiegruppen signifikant reducerade MADRS-poäng efter 0,5 mg/kg, och efter behandling med 1 mg/kg (R)-ketamin hos sex patienter med bipolär sjukdom, både typ I och typ II (53). Ingen av studierna indikerade en signifikant grad av dissociation eller andra allvarliga biverkningar av (R)-ketamin, men antalet patienter totalt är mycket begränsat.
Biverkningar/missbruk
Ketamin i doser som används för depression kan orsaka biverkningar som dissociation, hallucinationer, livliga drömmar, högt blodtryck, illamående, kräkningar, yrsel, huvudvärk, sömnighet och hypoestesi (49, 54). Racemisk ketamin i doser på 0,4-0,8 mg/kg, typisk dos för behandlingsresistent depression och liknande tillstånd, är förknippad med en ökad känsla av belöning (”liking”) (48).
Långvarig användning av ketamin är förknippad med neuroapoptotiska effekter som liknar åldrande och i uttalad form Alzheimers sjukdom, och daglig användning med förvärring av depression. Ketamin är också ett ämne som missbrukas, oftast inhaleras som pulver, men även oralt som vätska eller i tablettform. Missbruk (vilket innebär höga doser) orsakar typiska synhallucinationer och stark dissociation med signifikant störd verklighetsuppfattning samt gastrointestinala biverkningar, njur- och leverskador. Akut toxicitet behandlas vanligtvis med stimulusminskning och med ett minimum av ljud- och synintryck. Hypertoni och takykardi kan kräva läkemedelsbehandling och eventuell aggression eller agitation kan kräva behandling med bensodiazepiner (49, 54).
En genomgång av biverkningsrapporter till US Food and Drug Administration (FDA) under ett år (n=962) fann signaler om att (S)-ketamin nässpray var associerad med potentiellt allvarliga biverkningar som dissociation, sedering, berusningskänsla, självmordstankar och fullbordat självmord efter behandling (55). En systematisk review finner att förekomsten av allvarliga biverkningar som rapporterats i litteraturen vid användning av subanestetiska doser av ketamin är mycket låg, men betonar att underrapportering av biverkningar i den akademiska litteraturen är utbredd, och att små studier har låg sannolikhet att upptäcka sällsynta biverkningar (56).
Status i Norge och Sverige
I EU, inklusive Norge och Sverige, har intranasal (S)-ketamin en godkänd indikation i kombination med SSRI eller SNRI för vuxna med behandlingsresistent klinisk depression som inte svarat på minst två olika behandlingar med antidepressiva läkemedel i pågående moderat till svår depressiv episod. Intranasalt (S)-ketamin är även godkänd i kombination med oral antidepressiv behandling för vuxna som akut korttidsbehandling vid en psykiatrisk nödsituation (38, 39). Intranasal (S)-ketamin blev efter att en metodbedömning inte infört för behandlingsresistent depression i Norge 2020 och 2022 (57). Rådet för Nya Terapier (NT-rådet) i Sverige har rekommenderat att (S)-ketamin kan användas vid svår behandlingsresistent depression tillsammans med antidepressiva eller som akut korttidsbehandling när minst fyra andra behandlingsalternativ prövats (58).
Intravenöst racemiskt ketamin är endast godkänt som anestesiläkemedel i Norge och Sverige. För racemisk ketamin för injektion mot behandlingsresistent depression pågår en utredning och metodvärdering i Norge i nuläget (våren 2024) (59). Per juni 2024 finns det ingen central rekommendation för racemisk ketamin i Sverige för behandling av depression. I de nyutkomna kliniska riktlinjer för psykofarmakologi som ges ut av den Svenska psykiatriska föreningen likställs racematet med (S)-enantiomeren (29).
Diskussion
Den exakta verkningsmekanismen för ketamins antidepressiva effekt är för närvarande okänd. Det är troligt att flera mekanismer samverkar, men det är okänt vilka som är nödvändiga för effekten, och vilka som eventuellt orsakar biverkningar. Det är önskvärt att få detta klarlagt i långt större utsträckning. Samtidigt är de flesta läkemedel som används idag mot depression mekaniskt baserade på serotoninhypotesen (monoaminhypotesen), som fortfarande är kontroversiell 60 år efter att den först lades fram (42). Det behöver inte betyda att läkemedlen inte har effekt mot depression (det mätts i kliniska studier), men att vi inte säkert vet varför, och därmed vad verkningsmekanismen är.
Det finns i dagsläget en hel del vetenskapliga publikationer om ketamin för behandling av depression; en sökning i PubMed ger över 5 000 träffar i mitten av 2024. Många av dessa är översiktsartiklar och experimentella metaanalyser av små och heterogena studier. Behovet av nya översiktsartiklar och metaanalyser med varierande inklusions- och exklusionskriterier, och följaktligen urval, varje gång en ny studie om ketamin publiceras är begränsad (60).
Däremot finns det ett tydligt behov av större randomiserade och kontrollerade studier (RCT) som belyser vad som eventuellt är den optimala doseringen och administreringsform för ketamin, som visar effektens varaktighet, eller den nödvändiga och säkra behandlingstidens längd och hur bäst att fortsätta behandlingen för att minska risken för återfall efteråt. Det behövs också direkta jämförelser av racemisk ketamin, (S)-ketamin och (R)-ketamin. En aviserad kinesisk studie som skulle undersöka detta 2019 har fortfarande inte publicerats (61).
En sökning på clinicaltrials.gov efter ketamin och depression ger 80 träffar vid filtrering efter planerade och aktivt rekryterande studier, inklusive en australisk studie som jämför (S)-ketamin nässpray med intravenöst racemiskt ketamin. Studien är en parallell RCT där bedömare är förblindade och är planerad att avslutas 2027 (62).
I dagsläget kan man konstatera att ketamin kan ge en snabb och dramatisk effekt vid svårbehandlad depression; samtidigt finns det många frågor som rör hur mycket de två enantiomera bidrar, vilken beredning eller vilken enantiomer ger bäst risk-nytta-förhållande, hur längden och behandlingsformerna helst ska vara utformade, vilka kombinationer (litium, ECT, andra psykotropa substanser) är mest fördelaktiga och hur man bäst kan vidhålla den uppnådda effekten över tid.
I och med att depression är en fenomenologisk (och inte en etiologisk) diagnos kan tillståndets sannolika heterogenitet göra det svårare att komma till allmängiltiga slutsatser, samtidigt som forskning på ketamins effekter kanske kan belysa en del av patofysiologin som ligger bakom depressiva tillstånd.
Ett klokt förhållningssätt som värderar både nytta och risker kommer därför behövas och sannolikt i högre grad än för mera etablerade metoder. Varken en oreflekterad positiv tro i denna relativt nya terapiform eller ett kategoriskt förkastande bör styra användning, utan ett noggrannt, kritiskt värderande av det respektive aktuella kunskapsläget medveten om att den fortfarande är flytande och kommer att vara så under en tid framöver.
Tack till Harald Aiff, psykiater, med. dr., överläkare, Psykiatri Affectiva, Sahlgrenska Universitetssjukhuset och Ingrid Lunde Steen, sektionschef, master i farmaci, RELIS Midt-Norge för mycket hjälpsam akademisk och språklig korrekturläsning.
Ketamin ved depresjon og kiralitet – som hånd i hanske?
Introduksjon
Ketamin har blitt rapportert å gi en rask, men kortvarig effekt mot depressive symptomer, ikke minst på grunn av den mye raskere og mer dramatiske effekten enn konvensjonelle antidepressiva. Fordi ketamin også har et misbrukspotensial, har dette vært viet stor interesse med motstridende meninger.
Den ene av ketamins enantiomerer, (S)-ketamin, er godkjent for behandling av depresjon i et preparat som nesespray i både USA og Europa. Dyrestudier har vist en mulig bedre effekt av (R)-formen og en farmakokinetisk interaksjon mellom de to formene som fører til forlenget effektvarighet av racematet.
Kiraliteten til ketamin og dens mulige betydning blir derfor diskutert i denne artikkelen.
Kiralitet
Større molekyler kan i en to- eller tredimensjonal presentasjon ha forskjellige strukturformler selv om de har samme overordnede formel. Dette fenomenet kalles isomerisme.
Innenfor isomeri finnes det ulike varianter, blant annet den såkalte romlige isomerismen eller stereoisomerismen, hvor forskjellene først sees i en tredimensjonal presentasjon av formelen. Kirale molekyler har minst ett atom (ofte karbon) med fire forskjellige ligander. Dette gir to forskjellige former for denne delen av molekylet som er speilbilder av hverandre. Atomet i sentrum av disse fire liganden kalles et kiralt eller stereosenter og de to resulterende molekylene enantiomerer. En blanding med like proporsjoner av de to enantiomerene, kalles et racemat (eller racemisk blanding).
Kiralitet har betydning for egenskapene til molekylene. Et eksempel er aminosyren asparaginsyre, hvor kun en av enantiomerene smaker søtt, mens den andre er smakløs (1). Biokjemisk kan enzymer ofte bare håndtere en av de to enantiomerene og i interaksjon med reseptorer passer ofte (men ikke alltid) bare en av enantiomerene. Ofte er det også en forskjell i affinitet mellom de to enantiomerene. Dette kan føre til forskjellige farmakologiske effekter av de to enantiomerene og også til at en av enantiomerene brytes ned eller elimineres raskere enn den andre.
Kiralitet og nomenklatur
For å beskrive kiralitet finnes det forskjellige systemer. Tre systemer (+/-, D/L og R/S) er beskrevet her. Disse tre systemene er ikke relatert til hverandre; en kategorisering i et av systemene gir ingen kunnskap om hvilken kategori formen tilhører i noen av de to andre systemene.
Måling av optisk aktivitet (+/- og d/l)
Det eldste er systemet som beskriver hvordan disse stoffene påvirker rotasjonen av polarisert lys. En løsning med bare én av enantiomerene endrer lysets rotasjonsplan, noe som kan observeres med et polariserende filter. Avhengig av hvilken retning planet dreies når det passerer gjennom løsningen med stoffet, benvnes enantiomerene. Hvis lyset dreies til høyre (med klokken), kalles formen + (alternativt d for høyreroterende, dextrorotatory), dersom lyset dreies til venstre (mot klokken) som – (alternativt l for venstredreiende, levorotatory). Betegnelse med d og l bør unngås på grunn av risiko for forveksling med D/L-systemet (se nedenfor). Siden den samme enantiomeren kan påvirke polarisert lys på forskjellige måter avhengig av for eksempel pH-verdien, skjer navngivning under definerte omstendigheter. Systemet brukes ikke lenger for nye navn, men kan finnes i eldre litteratur eller med visse stoffer (for eksempel deksamfetamin, som er d-amfetamin).
D/L-systemet (Fischer-nomenklatur)
D/L-systemet spesifiserer en relativ konfigurasjon og bestemmes (se bildet) ved å tegne et multikarbonmolekyl i henhold til Fischer-projeksjonsregler med karbonkjeden fra topp til bunn. Karbonatomet med det laveste sekvensnummeret i henhold til IUPAC-reglene er tegnet øverst. Deretter tildeler man en prioritet til liganden på det kirale senteret nederst i kjeden og snur molekylet slik at karbonkjeden («R» på bildet) er bak bildeoverflaten og de horisontale ligandene er foran. Peker liganden med høyere prioritet (aminogruppen på bildet) til venstre, kalles formen L-enantiomeren (laevis, latin for venstre), peker den til høyre, kalles den D-enantiomeren (dexter, latin for høyre).
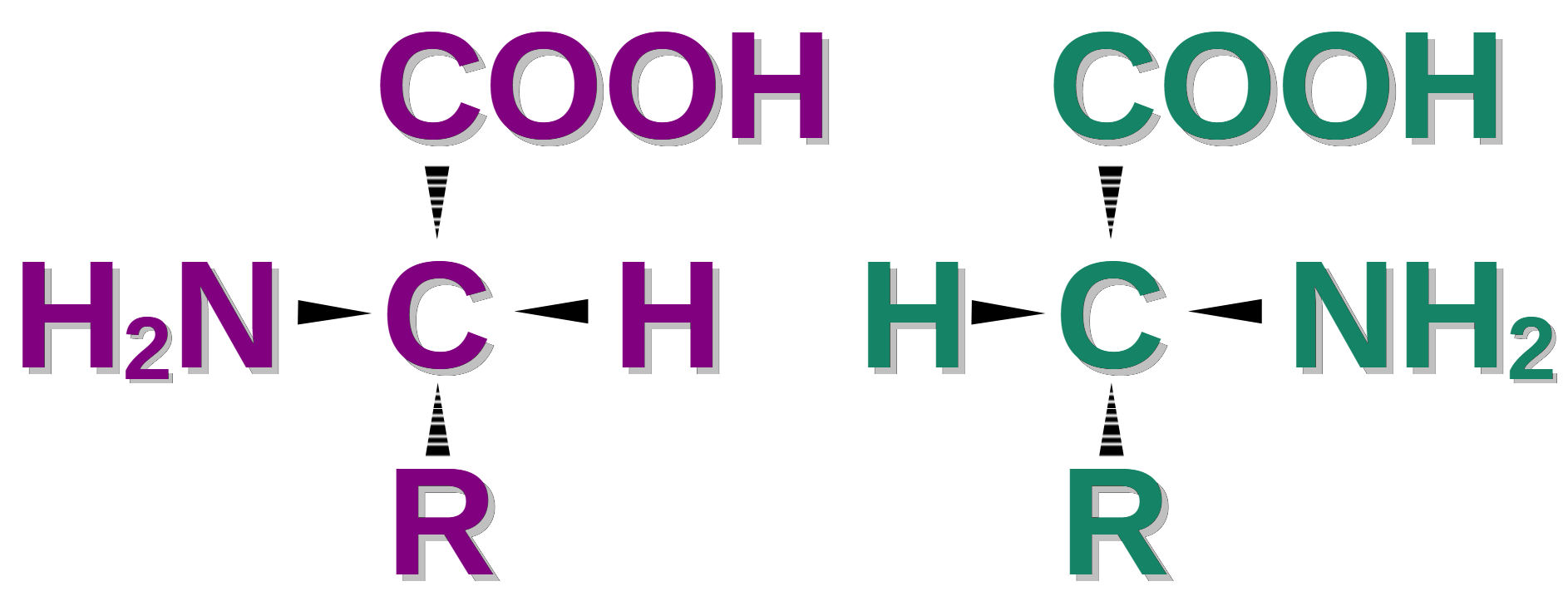
Dessverre er inndelingen ikke entydig. For eksempel for vinsyre, kan den samme enantiomeren refereres til som D- eller L-enantiomeren. Nomenklaturen brukes i dag oftest i forbindelse med aminosyrer eller ulike sukkermolekyler. D og L skrives som små store bokstaver, dvs. store bokstaver med mindre skriftstørrelse. Du bør ikke skrive med små bokstaver (d og l) for da er det stor fare for forveksling med +/- systemet, hvor d og l er brukt som alternativer til + og -.
Referanser:
Roberts JD, Caserio MC. The D, L Convention for Designating Stereochemical Configurations & Absolute And Relative Configuration. In: Basic Principles of Organic Chemistry. https://chem.libretexts.org/Bookshelves/Organic_Chemistry
R/S-systemet (Cahn–Ingold–Prelog-systemet (CIP)
Det mest moderne systemet beskriver en absolutt konfigurasjon, i motsetning til de to andre. Her tilordnes hver direkte ligand en prioritet basert på sitt atomnummer. Hvis to direkte ligander har samme atomnummer, brukes det neste atomet som er bundet til dem for sammenligningen. Liganden med lavest prioritet blir deretter vendt bort fra betrakteren og er skjult bak karbonatomet på bildet under. Deretter lages en sirkel fra liganden med høyest prioritet til lavest slik at retningen enten er med eller mot klokken (se pilene på bildet). Dersom sirkelen går med klokken (grønn under) er det en (R)-form (fra latin rectus, høyre eller rett). Hvis sirkelen går mot klokken (rød under) er det en (S)-form (fra latin sinister, venstre). R eller S skrives vanligvis i kursiv og i parentes. I noen tilfeller brukes prefikset es- (for (S)-formen) og ar- (for (R)-formen) brukes i stedet, spesielt når det kommer til legemiddelnavn, for eksempel esketamin, som korrekt heter (S)-ketamin.
Ketamin
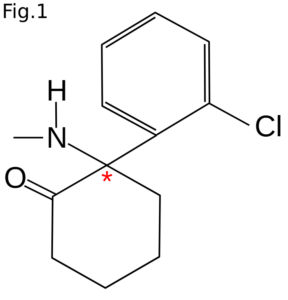 Ketamin ble introdusert under navnet CI-581 og ble opprinnelig produsert som et fensyklidin (PCP)-derivat (2). PCP hadde i kort tid vært brukt som bedøvelsesmiddel, men ble trukket tilbake i 1965 på grunn av bivirkninger. Molekylet for ketamin (2-(2-klorfenyl)-2-(metylamino)sykloheksan-1-on) har et kiralt senter. På bildet (fig. 1) er formelen vist med det kirale senteret merket med en rød stjerne (*).
Ketamin ble introdusert under navnet CI-581 og ble opprinnelig produsert som et fensyklidin (PCP)-derivat (2). PCP hadde i kort tid vært brukt som bedøvelsesmiddel, men ble trukket tilbake i 1965 på grunn av bivirkninger. Molekylet for ketamin (2-(2-klorfenyl)-2-(metylamino)sykloheksan-1-on) har et kiralt senter. På bildet (fig. 1) er formelen vist med det kirale senteret merket med en rød stjerne (*).
Ketamin brukes som et såkalt dissosiativt anestetikum. Ordet dissosiativ viser til en dissosiasjon mellom aktiviteten i de sentrale delene av hjernen og kortikale områder (hjernebarken) med økt aktivitet i de sentrale delene og svært langsom synkron aktivitet i hjernebarken, men uten spredning av disse nesten epileptiforme potensialene til andre deler av hjernen (2-4).
Allerede i de tidligste studiene ble det notert egenskaper som klart skilte seg fra de tidligere kjente anestetika (2, 4):
• hyperaktive reflekser under anestesi
• analgesi allerede under subnarkotiske doser
• økning i blodtrykket via en sentralnervøs sympatomimetisk effekt og samtidig, hvis blokkert, en reduksjon i blodtrykket via perifere vasodilatoriske og kardiodepressive effekter
• fravær av respirasjonsdempende effekt
• ”livlige drømmeaktige opplevelser eller rene hallusinasjoner”. Mellom 5-30% av forsøkspersonene opplevde livlige drømmer eller hallusinasjoner, som vanligvis avtok i løpet av én til to timer
Risikoen for hallusinasjoner eller atferdsavvik økte med dose, infusjonshastighet, alder og kjønn (høyere for kvinner) (2).
Farmakokinetikk
Metabolisme og metabolitter
 Ketamin metaboliseres hovedsakelig gjennom en N-demetylering til norketamin (se bildet) sannsynligvis via CYP3A4, men også til dels via CYP2B6, CYP2C9, CYP2C19 og CYP2D6 (5). For CYP2B6 er det funnet genetiske varianter som fører til endret clearance av ketamin (6). Norketamin metaboliseres deretter videre til forskjellige varianter av hydroksynorketamin (HNK), hvor hydroksygruppen kan sitte på forskjellige karbonatomer (posisjon 3, 4, 5 og 6, merket på fig. 2). Dette genererer et ekstra stereosenter, hvor det følgelig kan være to forskjellige stereoisomerer per posisjon (7).
Ketamin metaboliseres hovedsakelig gjennom en N-demetylering til norketamin (se bildet) sannsynligvis via CYP3A4, men også til dels via CYP2B6, CYP2C9, CYP2C19 og CYP2D6 (5). For CYP2B6 er det funnet genetiske varianter som fører til endret clearance av ketamin (6). Norketamin metaboliseres deretter videre til forskjellige varianter av hydroksynorketamin (HNK), hvor hydroksygruppen kan sitte på forskjellige karbonatomer (posisjon 3, 4, 5 og 6, merket på fig. 2). Dette genererer et ekstra stereosenter, hvor det følgelig kan være to forskjellige stereoisomerer per posisjon (7).
Bare en liten del av dosen elimineres som uendret ketamin (2%) eller norketamin (2%), men en rekke glukuronider av de ulike metabolittene utskilles i urinen, hvor ca 91% av stoffet kan gjenfinnes i løpet av fem dager. Ketamin induserer en rekke enzymer involvert i egen metabolisme in vitro (autoinduksjon) (8, 9) og hemmer metabolismen av blant annet morfin til dets inaktive 3-glukuronid. Dette kan bidra til en forsterket effekt av morfin når disse to legemidlene kombineres (4, 10, 11). Denne effekten brukes for eksempel ved behandling av alvorlige smertetilstander i forbindelse med kreft (12).
Plasmahalveringstiden for ketamin (racemat) er rapportert å være 2-4 timer (13).
Ketamins kiralitet
 Ketamin brukt til anestesiformål foreligger som et racemat (fig. 3) (14). Medisiner som inneholder ketamin som markedsføres for behandling av depresjon i dag inneholder (S)-ketamin (14-16), men mange innledende studier angående ketamins effekt på depresjon ble utført på racematet (17, 18).
Ketamin brukt til anestesiformål foreligger som et racemat (fig. 3) (14). Medisiner som inneholder ketamin som markedsføres for behandling av depresjon i dag inneholder (S)-ketamin (14-16), men mange innledende studier angående ketamins effekt på depresjon ble utført på racematet (17, 18).
Farmakokinetiske konsekvenser
En in vitro-studie undersøkte metabolismen av ketamin (racematet) via forskjellige CYP-enzymer og fant at CYP2B6 og CYP3A4 bidro mest til ketamins N-demetylering. En tydelig selektivitet ble sett for CYP3A4 som hadde en raskere metabolisme av (S)-ketamin sammenlignet med (R)-ketamin (19).
En studie med friske menn (n=10) har vist at clearance av (S)-ketamin var høyere enn for racematet og (R)-ketamin. I tillegg viste studien at clearance av (S)-ketamin var høyere i den rene isomeren enn i racematet. Ihmsen og medarbeidere konkluderte med at (R)-ketamin hemmer eliminering av (S)-ketamin (20).
Som konsekvens betyr dette at man kan forvente kortere effektvarighet ved bruk av (S)-ketamin enn ved bruk av racematet, dersom den antidepressive effekten påvirkes av fremfor alt konsentrasjonsforløpet av (S)-ketamin eller summen av begge enantiomerene.
Farmakodynamiske konsekvenser
Ganske kort tid etter at de psykotrope effektene av racematet ble oppdaget, begynte studier av hvilke effekter som kunne tilskrives hvilken enatiomer.
En studie med ti deltakere fant at tidligere beskrevne psykotiske symptomer (depersonalisering, hallusinasjoner), flat affekt og lydfølsomhet med innvirkning på deltakernes tankeinnhold og deres indre opplevelse oppstod ved bruk av (S)-, men ikke (R)-enantiomeren av ketamin. Under infusjon av (R)-ketamin beskrev noen deltakere en opplevelse av avspenning, som førte til et ikke-signifikant signal ispørsmålsskjemaene som ble brukt. I tillegg var det i PET-undersøkelsen en forskjell i metabolsk turnover av glukose, hvor man under infusjon av (S)-ketamin kunne se en kortikal og frontal betydelig økning i glukose turnover, mens man ved infusjon med (R)-ketamin så en reduksjon i omsetning hovedsakelig i temporomedial cortex og venstre insula. (21)
Samtidig ser (S)-ketamin ut til å ha høyere anestetisk potens, med høyere clearance og raskere restitusjon etter anestesi (22) og innebære høyere risiko for psykotiske opplevelser (23).
Interaksjon med målproteiner
Ketamin har blitt rapportert å interagere med mange og ulike reseptorer (23-26):
N-metyl-D-aspartat (NMDA)-reseptorer
NMDA-reseptorer (NMDAR) er ionotrope ligandstyrte glutamaterge reseptorer sammensatt av fire proteinsubenheter. Det finnes tre forskjellige typer subenheter (GluN1-3); typisk består en NMDAR av to GluN1-subenheter sammen med GluN2- eller GluN3-subenheter. Hver subenhet kan eksistere i ulike varianter gjennom alternativ spleising for GluN1 (åtte varianter), fire forskjellige gener for GluN2 og fire forskjellige gener for GluN3 (7, 27).
Dette mangfoldet fører til stor variasjon i funksjon og effekt. Hovedsakelig virker (S)-ketamin som en antagonist på NMDAR.Flere hypoteser om virkningsmekanismer bak ketamins antidepressive effekt som impliserer en større effekt av (S)-ketamin er fremsatt. De to viktigste er:
• Disinhiberingshypotesen antar at det er en subpopulasjon av NMDARer som sitter presynaptisk på GABAerge interneuroner som påvirkes. Ved å hemme utskillelsen av GABA, disinhiberes postsynaptiske glutamaterge nevroner, noe som fører til økt glutamaterg overføring. Den økte glutamaterge overføringen påvirker igjen andre systemer, for eksempel hjerneavledet nevrotrofisk faktor (BDNF), vaskulær endotelial vekstfaktor (VEGF) og insulinlignende vekstfaktor 1 (IGF-1) (28).
• Hypotesen om hemming av spontan NMDAR-mediert overføring antar at kontinuerlig glutamatergisk overføring via NMDAR-aktivering fører til en hemming av proteinsyntese og at en hemming av NMDAR dermed fører til økt syntese av proteiner med betydning for depressiv atferd.
Andre hypoteser omhandler endret produksjon av proteiner med kjent eller forventet effekt på depresjon som eukaryot forlengelsesfaktor 2-kinase (eEF2K), BDNF og indirekte påvirkning på for eksempel mekanistisk mål for rapamycin (mTOR) som en konsekvens av NMDAR-hemmingen. Disse teoriene favoriserer (S)-ketamin på grunn av dets høyere affinitet til reseptoren. BDNFs betydning bekreftes av at en variant i prodomenedelen av genet påvirker effekten av behandling med ketamin (29). Samtidig kan man ikke nå en tilsvarende antidepressiv effekt med andre NMDAR-antagonister som PCP eller memantin (30-32).
Alfa-amino-3-hydroksy-5-metyl-4-isoksazolpropionsyre (AMPA)-reseptorer
For to metabolitter, (2R,6R)-hydroksynorketamin, som er en metabolitt av (R)-ketamin, og i mindre grad (2S,6S)-hydroksynorketamin, har man vist interaksjon med reseptorer (mTOR og AMPAR (33, 34)) og i dyreforsøk effekt på en depresjonsmodell (33). Molekylenes kliniske effekt hos mennesker er fortsatt uklar.
Sigma-reseptorer
(R)-ketamin interagerer med en høyere affinitet enn (S)-ketamin med sigma-reseptorer og spesielt med sigma2-reseptorer. Aktivering av disse reseptorene har vært assosiert med antidepressive effekter (16, 25, 26, 34).
My-opioid-reseptorer
My-opioid-reseptorer (MOR) er en gruppe på tre G-proteinkoblede reseptorer (GPCR) som interagerer med endogene og eksogene opioider. MOR1 er mest assosiert med analgesi og den vanedannende effekten, MOR2 med eufori, respirasjonsdepresjon, forstoppelse og risiko for avhengighet, og MOR3 med vasodilatasjon (35). (S)-ketamin binder til MOR ved lavere konsentrasjoner enn (R)-ketamin (16).
Bruk og indikasjon
I år 2000 publiserte Berman og medarbeidere en studie hvor syv pasienter med alvorlig depresjon ble behandlet med 0,5 mg/kg racemisk ketamin. Studien fant redusert skår på Hamilton Depression Rating Scale (HDRS) 72 timer etter injeksjonen. Ut fra disse funnene konkluderte forfatterne med at NMDAR-modulerende midler kunne ha en rolle i behandlingen av depresjon (36, 37).
Mest oppsiktsvekkende var den relativt hurtige antidepressive effekten. Ketamin, i ulike formuleringer, isomere former og administrasjonsveier har etter dette vært gjenstand for studier som behandling av alvorlig depresjon (MDD), behandlingsresistent depresjon (TRD), bipolar lidelse, selvmordstanker og angst.
De fleste studier som er utført er på pasienter med TRD. TRD er i denne sammenhengen oftest definert som klinisk depresjon som ikke har respondert på minst to forskjellige behandlinger med antidepressiver i en moderat til alvorlig depressiv episode. Dette er i samsvar med definisjonen for TRD som er beskrevet i godkjent indikasjon for (S)-ketamin nesespray (38, 39).
Dersom ketamin, viser seg å være en effektiv behandling av MDD, TRD, bipolar lidelse, selvmordstanker eller angst vil den raskt innsettende effekten kunne bidra til å løse en vesentlig utfordring med dagens antidepressive behandling, der effektstørrelsen for legemidler generelt er mindre (40-42) og senere innsettende. Tid til effekt er også en uttalt utfordring ved ikke-medikamentell behandling som psykoterapi (med unntak for ECT) ved depressive lidelser.
Både effekter og bivirkninger av ketamin er doseavhengige. Både racematet og (S)-ketamin gir rask respons (timer-dager) med tilbakefall (dager-uker) både etter engangsbehandlingog ved gjentatt dosering. Regimer som er studert er dosering 1-3 ganger i uken med lengre intervaller etter fire uker (43). Tilsvarende observasjoner som for TRD er sett ved behandling av MDD (44). Dokumentasjon for effekt av racemisk ketamin og intranasal (S)-ketamin ved bipolar lidelse er betydelig mindre (45), og effekt mot selvmordstanker hos pasienter med TRD er antydet, men ikke dokumentert (46).
Det er flere ulemper knyttet til behandling med ketamin, blant annet bivirkningen dissosiasjon, men også praktiske aspekter som etablering av riktig dose, valg av administrasjonsvei og behandlingsvarighet i tillegg til sikkerhet ved behandling over tid. Selv om racemisk ketamin er et billig legemiddel gjør behovet for administrasjon under overvåkning det til en ressurskrevende og relativt kostbar behandling.
Det foreligger mange publikasjoner om ketamin i ulike former i behandling av depresjon og andre psykiske lidelser. Flere studiegrupper er representert med et betydelig antall artikler, delvis med varierende forfatterrekkefølge. Ulemper som understrekes i de fleste publikasjoner til nå er at de fleste studiene har svært få deltagere, og ofte har svak metodologisk utførelse. Et vesentlig problem er at behandlingen er vanskelig å blinde, spesielt sammenlignet med placebo, på grunn av dissosiasjon. Midazolam har i enkelte tilfeller vært forsøkt som komparator for å overkomme dette (44).
Disse utfordringene illustreres for eksempel i en sammenlignende observasjonsstudie av ketamin intravenøst versus (S)-ketamin intranasalt mot TRD (n=62), der omtrent halvparten av pasientene i studien samtidig ble behandlet med ulike andre psykotrope legemidler, blant annet SSRI eller SNRI, TCA, benzodiazepiner eller atypiske antipsykotika, i gjenomsnitt tre legemidler per pasient. Også behandling med ECT (40%) og TMS (transkranial magnetisk stimulering) forekom. Utover dette hadde pasientene komorbiditet som angst (>60%), PTSD (10%), fibromyalgi eller kroniske smerter og >10% hadde samtidig rusproblematikk (47).
De ulike og komplekse behandlingene sammen med ulike diagnosekombinasjoner gjør det vanskelig å trekke noen generelle konklusjoner om hvilken del av effekten som skyldes ketamins ulike formuleringer og administrasjonsveier.
Ketamin kan finnes som ulike formuleringer, og biotilgjengeligheten blir gradvis lavere avhengig av administrasjonsform: intravenøst, intramuskulært, subkutant, intranasalt, oralt (48). Intranasalt er biotilgjengeligheten av ketamin omtrent 30-50%, noe som medfører at administrert dose i mg må være relativt større enn ved intravenøs administrasjon for å oppnå samme konsentrasjon. Oralt har ketamin en biotilgjengelighet på 10-20% og førstepassasjemetabolisme gir 15-30 minutter forsinkelse i effekt sammenlignet med intranasal administrering (49).
Foreslått dosering
Racemisk ketamin intravenøst: 0,5 (0,1-1,0) mg/kg, eventuelt dosert etter idealvekt for overvektige, over 40 minutter. Observasjonstid minimum to timer. Enkeltdose har vist effekt på TRD i 3-7 dager, og gjentatt dosering i 2-3 uker, men det mangler studier på langtids- eller vedlikeholdsbehandling. De fleste pasienter har tilbakefall innen én måned (48).
(S)-ketamin intranasalt: 56 mg to ganger i uken titreres til 56-84 mg over fire uker, deretter 56-84 mg ukentlig i fire uker og vedlikehold med 56-84 mg hver, til annenhver, uke. Vedlikeholdsbehandling er studert i opptil ett år (48). Den godkjente preparatomtalen (SPC) til Spravato krever blodtrykksmåling etter omtrent 40 minutter, men lengre oppfølgingstid etter administrasjon bør vurderes (38, 39).
(S)-ketamin nesespray har noe mer systematisk og målrettet dokumentasjon ved TRD enn ketamin intravenøst. Dette kan i alle fall delvis skyldes at ketamin er generisk tilgjengelig for anestesi, mens (S)-ketamin nesespray er patentert og derfor nylig har gjennomgått nødvendige kliniske studier for godkjenning som tilleggsbehandling ved TRD (48). En systematisk oversikt og metaanalyse fant likevel at intravenøst racemisk ketamin både hadde bedre effekt og mindre bivirkninger ved TRD enn intranasalt (S)-ketamin (43). En observasjonell studie har funnet at intravenøst racemisk ketamin krever færre behandlinger enn intranasalt (S)-ketamin for å oppnå remisjon (47).
En annen systematisk oversikt og metaanalyse som omfattet ketamin og (S)-ketamin ved MDD, TRD, bipolar lidelse og selvmordstanker konkluderer med at kvaliteten og størrelsen på studier som foreligger er hovedsakelig svært lav og heterogen, og gode data på effekt og sikkerhet ved langtidsbehandling mangler, slik at det er vanskelig å trekke sikre konklusjoner (50).
(R)-ketamin
I 2021 gjennomførte Leal og medarbeidere en åpen pilotstudie der syv pasienter med TRD fikk infusjon av (R)-ketamin 0,5 mg/kg og forfatterne rapporterte signifikant reduksjon i Montgomery-Åsberg Depression Rating Scale (MADRS) skår etter ett døgn, tilsynelatende uten forekomst av dissosiasjon hos pasientene (51). Samme studiegruppe fant derimot ingen forskjell fra placebo i et randomisert, dobbeltblindet overkrysningsforsøk hos 10 pasienter med TRD (52).
I en annen åpen, pilotstudie fant studiegruppen signifikant redusert MADRS-skår etter 0,5 mg/kg, deretter 1 mg/kg (R)-ketamin hos seks pasienter med bipolar lidelse, både type I og type II (53). Ingen av studiene indikerte vesentlig grad av dissosiasjon eller andre alvorlige bivirkninger av (R)-ketamin, men antallet pasienter totalt er svært begrenset.
Bivirkninger/misbruk
Ketamin i doser brukt ved depresjon kan gi bivirkninger i form av blant annet dissosiasjon, hallusinasjoner, livlige drømmer, hypertensjon, kvalme, oppkast, svimmelhet, hodepine, søvnighet og hypoestesi (49, 54). Racemisk ketamin i doser på 0,4-0,8 mg/kg, typisk dosering ved TRD og lignende tilstander, er assosiert med økt belønningsfølelse (“liking”) (48).
Langtidsbruk av ketamin er assosiert med nevroapoptotiske effekter som ligner aldring og Alzheimers sykdom, og daglig bruk med forverring av depresjon. Ketamin er også en substans som misbrukes, oftest inhalert som pulver, men også oralt som flytende eller i tablettform. Misbruk (høye doser) gir typisk visuelle hallusinasjoner og kraftig dissosiasjon med betydelig forstyrret virkelighetsoppfatning samt gastrointestinale bivirkninger, nyre- og leverskade. Akutt toksisitet behandles vanligvis med ro og minimalt med lyd- og visuelle inntrykk. Hypertensjon og takykardi kan kreve medikamentell behandling og eventuell aggresjon eller agitasjon kan kreve behandling med benzodiazepiner (49, 54).
En gjennomgang av bivirkningsrapporter til det amerikanske Food and Drug Administration (FDA) gjennom ett år (n=962) fant signaler på at (S)-ketamin nesespray var assosiert med potensielt alvorlige bivirkninger som dissosiasjon, sedasjon, følelse av beruselse, selvmordstanker og gjennomført selvmord etter behandling (55). En systematisk oversikt har antydet at forekomsten av alvorlige bivirkninger som er rapportert i litteraturen ved bruk av subanestetiske doser av ketamin er svært lav, men understreker at underrapportering av bivirkninger i akademisk litteratur er utbredt, og at små studier har lav sannsynlighet for å oppdage sjeldne bivirkninger (56).
Status i Norge og Sverige
I EU, inkludert Norge og Sverige, har (S)-ketamin intranasalt godkjent indikasjon i kombinasjon med et SSRI eller SNRI til voksne med behandlingsresistent klinisk depresjon som ikke har respondert på minst to ulike behandlinger med antidepressiva i den pågående moderate til alvorlige depressive episoden. (S)-ketamin intranasalt er også godkjent i kombinasjon med oral antidepressiv behandling til voksne som akutt korttidsbehandling i en psykiatrisk nødsituasjon (38, 39). (S)-ketamin intranasalt ble etter metodevurdering avvist innført ved TRD i Norge i 2020 og 2022 (57). Rådet för Nya terapier (NT-rådet) i Sverige har anbefalt at (S)-ketamin kan brukes ved alvorlig TRD sammen med anitidepressiva eller som akutt korttidsbehandling når minst fire andre behandlingsmuligheter er utprøvd (58).
Intravenøst racemisk ketamin er bare godkjent som anestetikum i Norge og Sverige. Racemisk ketamin til injeksjon mot TRD er under en pågående fullstendig metodevurdering i Norge våren 2024 (59). For racemisk ketamin finnes det i Sverige per juni 2024 ingen sentral anbefaling med hensyn til depresjon. I de nyutgitte kliniske retningslinjene for psykofarmakologi som gis ut av den Svenska psykiatriska föreningen likestilles racematet med (S)-enantiomeren (29).
Diskusjon
Den eksakte virkningsmekanismen for ketamins antidepressive effekt er foreløpig ukjent, ved MDD, TRD, bipolar sykdom og selvmordstanker. Det er sannsynlig at flere mekanismer samvirker, men ukjent hvilke som er nødvendige for effekt, og hvilke som eventuelt forårsaker bivirkninger. Det er ønskelig å få klarlagt dette i langt større grad. Samtidig er de fleste legemidler som i dag benyttes mot depresjon mekanistisk basert på serotoninhypotesen (monoaminhypotesen), som fremdeles er kontroversiell 60 år etter at den først ble fremsatt (42). Dette betyr ikke nødvendigvis at legemidlene ikke har effekt mot depresjon, det må studier vise, men at vi ikke sikkert vet hvorfor, og altså hva som er virkningsmekanismen.
Det foreligger etter hvert ganske mange vitenskapelige publikasjoner om ketamin til behandling av depresjon, et søk i PubMed gir medio 2024 over 5000 treff. Mange av disse er oversiktsartikler og forsøksvise metaanalyser av små og lite sammenlignbare studier. Det er ikke først og fremst et behov for nye oversiktsartikler og metaanalyser, med varierende inklusjons- og eksklusjonskriterier, og følgelig utvalg, hver gang en ny studie om ketamin publiseres (60).
Det er et klart behov for større randomiserte og kontrollerte studier (RCT) som belyser hva som eventuelt er riktig dosering og administrasjonsform for ketamin, som viser varigheten av effekt, eller nødvendig og trygg lengde på behandlingsperiode og hvordan man best kan fortsette behandlingen for å redusere risikoen for tilbakefall i etterkant. Det trengs også direkte sammenligninger av racemisk ketamin, (S)-ketamin og (R)-ketamin. En bebudet kinesisk studie som skulle undersøke dette i 2019 er fremdeles ikke publisert (61).
Et søk på clinicaltrials.gov etter ketamin og depresjon gir 80 treff ved filtrering for planlagte og studier med aktiv rekruttering, blant annet en australsk studie som sammenligner (S)-ketamin nesespray med intravenøs racemisk ketamin. Studien er en parallell RCT hvor bedømmere er blindet og er planlagt avsluttet i 2027 (62).
Foreløpig kan man slå fast at ketamin kan gi en rask og dramatisk effekt ved behandlingsresistent depresjon, men det er mange uavklarte spørsmål om; hvor mye de to enantiomerene bidrar med, hvilket preparat eller hvilken enantiomer som gir best risiko-nytte-forhold, hvordan behandlingslengden og -formene ideelt sett bør utformes, hvilke kombinasjoner (litium, ECT, andre psykotrope stoffer) som er mest fordelaktig og hvordan man best kan opprettholde den oppnådde effekten over tid.
Ettersom depresjon er en fenomenologisk (og ikke etiologisk) diagnose, kan tilstandens heterogenitet gjøre det vanskeligere å komme til generelle konklusjoner, mens forskning på ketamins effekter kanskje kan belyse patofysiologien som ligger til grunn for depressive tilstander.
En klok tilnærming som verdsetter både fordeler og risiko vil derfor være nødvendig, sannsynligvis i større grad enn for mer etablerte metoder. Verken en ureflektert positiv tro på denne relativt nye terapiformen eller en kategorisk avvisning bør være retningsgivende for bruk, men en nøye, kritisk vurdering av det nåværende kunnskapsgrunnlaget, og bevissthet om at det fortsatt er i endring og vil være det i en tid fremover.
Takk til Harald Aiff, psykiater, dr.med., overlege ved Psykiatri Affektiva, Sahlgrenska universitetssjukhuset og Ingrid Lunde Steen, leder, master i farmasi ved RELIS Midt-Norge for svært hjelpsom faglig og språklig korrektur.
Referenser
- Gal J. The discovery of stereoselectivity at biological receptors: Arnaldo Piutti and the taste of the asparagine enantiomers – history and analysis on the 125th anniversary. Chirality 2012; 24(12): 959-76.
- White PF, Way WL et al. Ketamine – its pharmacology and therapeutic uses. Anesthesiology 1982; 56(2): 119-36.
- Corssen G, Miyasaka M et al. Changing concepts in pain control during surgery: dissociative anesthesia with CI-581. A progress report. Anesth Analg 1968; 47(6): 746-59.
- Domino EF, Chodoff P et al. Pharmacologic effects of CI-581, a new dissociative anesthetic, in man. Clin Pharmacol Ther 1965; 6: 279-91.
- Dinis-Oliveira RJ. Metabolism and metabolomics of ketamine: a toxicological approach. Forensic Sci Res 2017; 2(1): 2-10.
- Awad H, Ahmed A et al. Potential role of pharmacogenomics testing in the setting of enhanced recovery pathways after surgery. Pharmgenomics Pers Med 2019; 12: 145-54.
- Hess EM, Riggs LM et al. Mechanisms of ketamine and its metabolites as antidepressants. Biochem Pharmacol 2022; 197: 114892.
- Chan WH, Sun WZ et al. Induction of rat hepatic cytochrome P-450 by ketamine and its toxicological implications. J Toxicol Environ Health A 2005; 68(17-18): 1581-97.
- Marietta MP, White PF et al. Biodisposition of ketamine in the rat: self-induction of metabolism. J Pharmacol Exp Ther 1976; 196(3): 536-44.
- Corssen G, Domino EF. Dissociative anesthesia: further pharmacologic studies and first clinical experience with the phencyclidine derivative CI-581. Anesth Analg 1966; 45(1): 29-40.
- Qi X, Evans AM et al. Inhibition of morphine metabolism by ketamine. Drug Metab Dispos 2010; 38(5): 728-31.
- Helse Bergen. Smertebehandling. I: Anestesi (HUS). https://metodebok.no/ (Sist oppdatert: 21. oktober 2022).
- Domino EF, Zsigmond EK et al. Plasma levels of ketamine and two of its metabolites in surgical patients using a gas chromatographic mass fragmentographic assay. Anesth Analg 1982; 61(2): 87-92.
- Jelen LA, Young AH et al. Ketamine: A tale of two enantiomers. J Psychopharmacol 2021; 35(2): 109-23.
- Andrade C. Ketamine for Depression, 3: Does Chirality Matter? J Clin Psychiatry 2017; 78(6): e674-e677.
- Bonaventura J, Lam S et al. Pharmacological and behavioral divergence of ketamine enantiomers: implications for abuse liability. Mol Psychiatry 2021; 26(11): 6704-22.
- da Frota Ribeiro CM et al. The Use of Ketamine for the Treatment of Depression in the Context of Psychotic Symptoms: To the Editor. Biol Psychiatry 2016; 79(9): e65-e66.
- Pennybaker SJ, Luckenbaugh DA et al. Ketamine and Psychosis History: Antidepressant Efficacy and Psychotomimetic Effects Postinfusion. Biol Psychiatry 2017; 82(5): e35-e36.
- Portmann S, Kwan HY et al. Enantioselective capillary electrophoresis for identification and characterization of human cytochrome P450 enzymes which metabolize ketamine and norketamine in vitro. J Chromatogr A 2010; 1217(51): 7942-8.
- Ihmsen H, Geisslinger G et al. Stereoselective pharmacokinetics of ketamine: R(-)-ketamine inhibits the elimination of S(+)-ketamine. Clin Pharmacol Ther 2001; 70(5): 431-8.
- Vollenweider FX, Leenders KL et al. Differential psychopathology and patterns of cerebral glucose utilisation produced by (S)- and (R)-ketamine in healthy volunteers using positron emission tomography (PET). Eur Neuropsychopharmacol 1997; 7(1): 25-38.
- Muller J, Pentyala S et al. Ketamine enantiomers in the rapid and sustained antidepressant effects. Ther Adv Psychopharmacol 2016; 6(3): 185-92.
- Hashimoto K. Rapid-acting antidepressant ketamine, its metabolites and other candidates: A historical overview and future perspective. Psychiatry Clin Neurosci 2019; 73(10): 613-27.
- Paul RK, Singh NS et al. (R,S)-Ketamine metabolites (R,S)-norketamine and (2S,6S)-hydroxynorketamine increase the mammalian target of rapamycin function. Anesthesiology 2014; 121(1): 149-59.
- Zanos P, Moaddel R et al. Ketamine and Ketamine Metabolite Pharmacology: Insights into Therapeutic Mechanisms. Pharmacol Rev 2018; 70(3): 621-60.
- Zhang JC, Yao W, Hashimoto K. Arketamine, a new rapid-acting antidepressant: A historical review and future directions. Neuropharmacology 2022; 218: 109219.
- Vyklicky V, Korinek M et al. Structure, function, and pharmacology of NMDA receptor channels. Physiol Res 2014; 63(Suppl 1): S191-203.
- Borsellino P, Krider RI et al. Ketamine and the Disinhibition Hypothesis: Neurotrophic Factor-Mediated Treatment of Depression. Pharmaceuticals (Basel) 2023; 16(5): 742.
- Aiff H, Andresen M. Ketamin. I: Psykofarmakologi Kliniska riktlinjer för utredning och behandling 2024. Svenska Psykiatriska Föreningen: 319-31. https://www.gothiakompetens.se/psykofarmakologi-p77414186
- Ferguson JM, Shingleton RN. An open-label, flexible-dose study of memantine in major depressive disorder. Clin Neuropharmacol 2007; 30(3): 136-44.
- Lenze EJ, Skidmore ER et al. Memantine for late-life depression and apathy after a disabling medical event: a 12-week, double-blind placebo-controlled pilot study. Int J Geriatr Psychiatry 2012; 27(9): 974-80.
- Zarate CA Jr, Singh JB et al. A double-blind, placebo-controlled study of memantine in the treatment of major depression. Am J Psychiatry 2006; 163(1): 153-5.
- Aleksandrova LR, Wang YT et al. Hydroxynorketamine: Implications for the NMDA Receptor Hypothesis of Ketamine’s Antidepressant Action. Chronic Stress (Thousand Oaks) 2017; 1: 2470547017743511.
- Zanos P, Moaddel R. NMDAR et al. NMDAR inhibition-independent antidepressant actions of ketamine metabolites. Nature 2016; 533(7604): 481-6.
- Dhaliwal A, Gupta M. Physiology, Opioid Receptor. In: StatPearls. http://www.ncbi.nlm.nih.gov/books/NBK546642/ (Sist oppdatert: 23. Juli 2023).
- Berman RM, Cappiello A et al. Antidepressant effects of ketamine in depressed patients. Biol Psychiatry 2000; 47(4): 351-4.
- Wei Y, Chang L et al. A historical review of antidepressant effects of ketamine and its enantiomers. Pharmacol Biochem Behav 2020; 190: 172870.
- Direktoratet for medisinske produkter. Preparatomtale (SPC) Spravato. https://www.legemiddelsok.no/ (Sist oppdatert: 23. Mai 2024).
- Läkemedelsverket. Preparatomtale (SPC) Spravato. https://lakemedelsverket.se/ (Sist endret: 23. mai 2024).
- Jakobsen JC, Katakam KK et al. Selective serotonin reuptake inhibitors versus placebo in patients with major depressive disorder. A systematic review with meta-analysis and Trial Sequential Analysis. BMC Psychiatry 2017; 17(1): 58.
- Langaas HC, Roland PDH. Hvor effektive er egentlig SSRI mot depresjon? https://relis.no/artikler/27849 (Publisert: 6. april 2017).
- Moncrieff J, Cooper RE et al. The serotonin theory of depression: a systematic umbrella review of the evidence. Mol Psychiatry 2023; 28(8): 3243-56.
- Terao I, Tsuge T et al. Comparative efficacy, tolerability and acceptability of intravenous racemic ketamine with intranasal esketamine, aripiprazole and lithium as augmentative treatments for treatment-resistant unipolar depression: A systematic review and network meta-analysis. J Affect Disord 2024; 346: 49-56.
- Nikolin S, Rodgers A et al. Ketamine for the treatment of major depression: a systematic review and meta-analysis. EClinicalMedicine 2023; 62: 102127.
- Nunez NA, Joseph B et al. An Update on the Efficacy of Single and Serial Intravenous Ketamine Infusions and Esketamine for Bipolar Depression: A Systematic Review and Meta-Analysis. Brain Sci 2023; 13(12): 1672.
- Wang YT, Wang XL et al. A systematic review and meta-analysis of the efficacy of ketamine and esketamine on suicidal ideation in treatment-resistant depression. Eur J Clin Pharmacol 2024; 80(2): 287-96.
- Singh B, Kung S et al. Comparative Effectiveness of Intravenous Ketamine and Intranasal Esketamine in Clinical Practice Among Patients With Treatment-Refractory Depression: An Observational Study. J Clin Psychiatry 2023; 84(2): 22m14548.
- McIntyre RS, Rosenblat JD et al. Synthesizing the Evidence for Ketamine and Esketamine in Treatment-Resistant Depression: An International Expert Opinion on the Available Evidence and Implementation. Am J Psychiatry 2021; 178(5): 383-99.
- Vujović KS, Jotić A et al. Ketamine, an Old-New Drug: Uses and Abuses. Pharmaceuticals (Basel) 2024 17(1): 16.
- Rodolico A, Cutrufelli P et al. Efficacy and safety of ketamine and esketamine for unipolar and bipolar depression: an overview of systematic reviews with meta-analysis. Front Psychiatry 2024; 15: 1325399.
- Leal GC, Bandeira ID et al. Intravenous arketamine for treatment-resistant depression: open-label pilot study. Eur Arch Psychiatry Clin Neurosci 2021; 271(3): 577-82.
- Leal GC, Souza-Marques B et al. Arketamine as adjunctive therapy for treatment-resistant depression: A placebo-controlled pilot study. J Affect Disord 2023; 330: 7-15.
- Bandeira ID, Leal GC et al. Arketamine for bipolar depression: Open-label, dose-escalation, pilot study. J Psychiatr Res 2023; 164: 229-34.
- Boudieu L, Mennetrier M et al. The Efficacy and Safety of Intranasal Formulations of Ketamine and Esketamine for the Treatment of Major Depressive Disorder: A Systematic Review. Pharmaceutics. 2023; 15(12): 2773.
- Gastaldon C, Raschi E et al. Post-Marketing Safety Concerns with Esketamine: A Disproportionality Analysis of Spontaneous Reports Submitted to the FDA Adverse Event Reporting System. Psychother Psychosom 2020; 90(1): 41-8.
- Hovda N, Gerrish W et al. A systematic review of the incidence of medical serious adverse events in sub-anesthetic ketamine treatment of psychiatric disorders. Journal of Affective Disorders 2024; 345: 262-71.
- Nye metoder. Esketamin (Spravato). https://www.nyemetoder.no/metoder/esketamin-spravato (Sist oppdatert: 13. februar 2023).
- Nya terapier. Spravato (esketamin). https://samverkanlakemedel.se/produktinfo/spravato-esketamin (Sist oppdatert: 30. juni 2021).
- Nye metoder. Ketamin. https://www.nyemetoder.no/metoder/ketamin/ (Sist oppdatert: 18. mars 2024).
- Johnston JN, Henter ID et al. The antidepressant actions of ketamine and its enantiomers. Pharmacol Ther 2023; 246: 108431.
- Zhang K, Wang G et al. Efficacy and safety of ketamine, S-ketamine and R-ketamine in the treatment of resistant depression: a randomized controlled trial. https://www.chictr.org.cn/showprojEN.html?proj=26844 (Sist oppdatert: 17. mai 2019).
- The Geroge institute. Comparative Effectiveness Study of Two Forms of Ketamine for Treatment-resistant Depression (TREK). https://clinicaltrials.gov/study/NCT06278779 (Sist oppdatert: 4. juni 2024).
Forfattere
