Legemiddeldetektiver i praksis – farmasøyter avdekker ukjente bivirkninger
- Publicerad: 01.02.2023
Ønske om flere meldinger fra farmasøyter
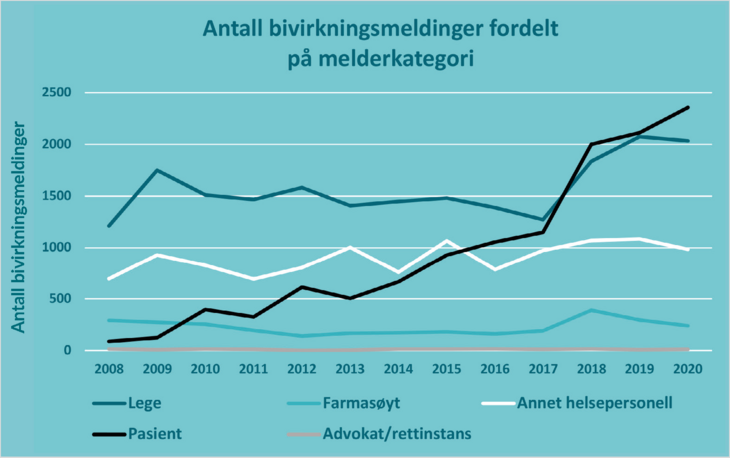
Farmasøyter har alltid hatt rett, men ikke plikt, til å melde legemiddelbivirkninger, og har tidligere blitt spesielt oppfordret til å rapportere om bivirkninger ved blant annet likeverdig bytte, bruk av legemidler som selges uten resept og natur(lege)midler (1). Figur 1 viser at antall bivirkningsmeldinger som årlig sendes inn av farmasøyter har vært relativt stabilt, men lavt (2). Det er ønskelig med flere meldinger fra farmasøyter, og innføringen av Bivirkningsregisterforskriften 1. januar 2020 ga alt helsepersonell, ikke bare leger og tannleger, meldeplikt for mistenkte nye, alvorlige og uventede bivirkninger av legemidler (3). Vi forventer at den utvidede meldeplikten fører til flere meldinger fra farmasøyter i årene fremover.
Farmasøyter bidrar til å avdekke ukjente bivirkninger
I arbeidshverdagen er de fleste farmasøyter i direkte kontakt med legemiddelbrukere, og dermed i en unik posisjon til å avdekke bivirkninger. Den muntlige kontakten med legemiddelbrukeren gir anledning til å skape en god dialog ved mistanke om bivirkning; om legemidlet, hendelsesforløpet knyttet til de aktuelle reaksjonene og tidsrelasjon med inntak av det aktuelle legemidlet.

I mange tilfeller vil farmasøyter gjennom slike dialoger avdekke vanlige og ufarlige bivirkninger, som likevel kan skape usikkerhet hos pasienten. Farmasøyten har da en viktig oppgave i å trygge pasientene, avklare når det kan være aktuelt å kontakte lege, og dermed bidra til å unngå uhensiktsmessig legemiddelbruk. Dersom farmasøyten vurderer at bivirkningen ikke er meldepliktig eller ikke tilfører nyttig kunnskap, kan pasienten eventuelt henvises til å melde selv (helsenorge.no).
I andre tilfeller vil dialogen, enten med pasient eller tverrfaglig team, kunne avdekke informasjon om nye, uventede eller mer alvorlige reaksjoner, uavhengig av om legemidlet er brukt som beskrevet i produktinformasjonen. Farmasøyters faglige vurdering av informasjonen fra legemiddelbrukeren er av stor verdi, og ved å melde fra om sin mistanke om bivirkninger kan farmasøyter bidra til å avdekke nye bivirkninger eller beskrive kjente bivirkninger nærmere.
På neste side følger eksempler på ukjente problemer med legemidler som farmasøyter har bidratt til å avdekke, i det første tilfellet dreier det seg om til da ukjente bivirkninger som misbruk og avhengighet, og i det andre eksemplet bivirkninger ved bruk av legemiddel utenfor godkjent indikasjon (off-label-bruk).
Farmasøyter – spesielt egnet til å melde bivirkninger
Farmasøyter er særlig godt egnet til å vurdere om et symptom kan være en bivirkning, fordi farmasøyter:
- har kunnskap om legemidlers virkningsmekanismer og farmakokinetikk, samt egenskaper ved legemiddelformene
- vurderer helhetlig legemiddelbruk gjennom samstemming, legemiddelgjennomganger og pasientsamtaler
Hvilke bivirkninger som skal meldes, samt vurdering av om et symptom kan være en mulig bivirkning er omtalt i artikkelen «Bli ein legemiddeldetektiv», publisert i NFT nr. 8/2022 (4).

Husk at du ikke trenger å være sikker på at det er en bivirkning for å melde. Meld på mistanke – vi er på utkikk etter ny sikkerhetsinformasjon om legemidler.
Avdekket misbruks- og avhengighetspotesial av pregabalin
Da pregabalin (Lyrica) fikk markedsføringstillatelse i 2004, tydet dokumentasjon som lå til grunn for markedsføringstillatelsen på at avhengighets- og misbrukspotensialet var lavt, og pregabalin ble plassert i reseptgruppe C. Allerede i juli 2005 kom den første henvendelsen til spørsmål-svar-tjenesten til RELIS om at pregabalin kunne ha misbruks- og avhengighetspotensial. Bakgrunnen var en farmasøyt som hadde registrert forskrivning og uttak av pregabalin med en frekvens som tilsa inntak av tidobbel maksimumsdose (5).
I etterkant fikk RELIS en rekke henvendelser både fra farmasøyter og leger om misbruk og/eller avhengighet av pregabalin. For å ha mulighet til å samle informasjonen og analysere om det aktuelle kunne være et mulig bivirkningssignal, ble spørsmålsstillerne oppfordret til å sende inn bivirkningsmelding ved mistanke om misbruk/avhengighet hos konkrete personer. Det kom da inn flere titalls bivirkningsmeldinger med mistanke om eufori, misbruk, avhengighet, toleranseutvikling og/eller seponeringsreaksjoner ved bruk av pregabalin.
Signalet fra de norske bivirkningsrapportene ble etter hvert styrket av rapporter fra andre land. I 2010 ble preparatomtalen oppdatert med informasjon om at tilfeller på misbruk av pregabalin var registrert, at forsiktighet bør utvises hos pasienter med kjent rusmisbruk, samt at man bør overvåke for symptomer på misbruk hos pasienter som bruker pregabalin. Videre besluttet Legemiddelverket i 2018 å flytte pregabalin fra reseptgruppe C til reseptgruppe B, etter en grundig gjennomgang av innrapporterte bivirkningsmeldinger og publisert litteratur. Hensikten med endring av reseptgruppestatus var å tydeliggjøre risikoen for misbruk og avhengighet både for forskrivere og pasienter. På denne måten bidro norske farmasøyter og leger, gjennom henvendelser til RELIS og påfølgende bivirkningsmeldinger, til å avdekke at pregabalin har et betydelig misbruks- og avhengighetspotensial, som ikke var kjent da legemidlet ble markedsført (6, 7).
Uhensiktsmessig off-label-bruk av Capsina krem (capsaicin)
En annen problemstilling farmasøyter har avdekket, er bivirkninger etter uhensiktsmessig bruk av Capsina (capsaicin) krem. RELIS har behandlet bivirkningsmeldinger hvor pasienter har gitt tilbakemelding til farmasøyter om uutholdelig brennende, sviende smerte på applikasjonsstedet etter bruk av Capsina krem mot analkløe. Plagene var så intense at pasienter valgte å seponere behandlingen etter kun en enkelt påføring. Ved søk i aktuelle kilder fant RELIS en sannsynlig årsak til symptomene.

Capsina krem 0,075 % (0,75 mg/g) inneholder capsaicin, som blant annet finnes i chili og cayennepepper. Godkjent indikasjon er symptomatisk behandling av postherpetisk nevralgi (8). Bruk av Capsina krem mot analkløe er utenfor godkjent indikasjon (off-label), men RELIS fant ved søk at capsaisin foreslås ved denne indikasjonen i noen få kilder. Oppslagsverket UpToDate foreslår at capsaicin kan forsøkes mot behandlingsresistente symptomer etter grundige tilleggsundersøkelser, men da i styrke 0,006 % (0,06 mg/g) (9). Noen norske oppslagsverk anga på meldetidspunktet at Capsina krem kunne forsøkes ved behandlingsresistent analkløe.
Kilden som oppslagsverkene oppgir, er én studie hvor topikal capsaicin ble undersøkt mot idiopatisk behandlingsresistent analkløe (10), og denne er også den eneste studien vi har funnet ved søk i medisinske databaser som har undersøkt bruk av topikal capsaicin mot analkløe. Den topikale formuleringen som ble brukt i studien, var et magistrelt fremstilt preparat som inneholdt kun 0,06 mg capsaicin per gram krem (0,006 %), noe som er betydelig svakere enn Capsina krem som inneholder mer enn tolv ganger høyere konsentrasjon capsaicin (0,75 mg/g). Forfatterne angir at de valgte å fortynne til 0,006 % siden perianal-området er veldig sensitivt og fordi 3 av 4 av pasientene var nødt til seponere på grunn av perianal svie/brenning i pilotstudien hvor konsentrasjonen 0,012 % (0,12 mg/g) ble brukt. Selv ved konsentrasjonen på 0,006 % droppet fire av 44 pasienter ut av studien på grunn av uutholdelig brennende følelse, og én pasient på grunn av elveblest (urtikaria). Alle pasientene hadde mild til moderat grad av perianal svie etter påføring av capsaicin (10). Det kan legges til at studien er fra 2003 og resultatene må ses på som hypotesesettende, og er ikke gjentatt i metodologisk robuste studier.
Den norske preparatomtalen angir skadet og betent hud som kontraindikasjon for bruk av Capsina krem. Videre angis det at det aktive virkestoffet gir opphav til irritasjon i øyne og på hud, noe som er forventet ut fra virkestoffets egenskaper. Både preparatomtaler og oppslagsverk oppgir at kontakt med øyne og slimhinner skal unngås (8, 11).
Ut fra den tilgjengelige litteraturen er bivirkningene pasientene opplevde logiske og forklarlige. I slike tilfeller kan det være behov for oppdatert informasjon for å gjøre behandlingen mer hensiktsmessig. Bruk av det markedsførte preparatet (Capsina) ved analkløe kan gi svært sterke plager hos pasienter, og egner seg derfor trolig ikke til bruk på denne indikasjonen i ufortynnet form. I dette tilfellet ga RELIS tilbakemelding til de norske oppslagsverkene om forskjellen i styrke på det markedsførte preparatet og det magistrelt fremstilte preparatet som ble brukt i ovennevnte studie, samt at det er rapportert bivirkninger. Oppslagsverkene valgte på bakgrunn av dette å endre omtalen av capsaicin og fraråde bruk av styrken 0,075 % mot analkløe. Andre tiltak RELIS gjør i slike tilfeller er å videreføre informasjonen til helsepersonell og Legemiddelverket.
Meld på mistanke, du trenger ikke være sikker!
Eksemplene illustrerer hvordan farmasøyters årvåkenhet kan være avgjørende i arbeidet med å avdekke ukjente bivirkninger og problemer rundt legemiddelbruk. Har du observert problemer knyttet til legemidler eller alvorlige eller uventede bivirkninger? Da oppfordrer vi deg til å melde det som bivirkning på melde.no. Økt kunnskap om legemidlenes sikkerhetsprofil er viktig for pasientsikkerheten og vil komme fremtidige pasienter til gode. Er du i tvil om du bør melde, eller ønsker å diskutere en mistanke om bivirkning, er du velkommen til å kontakte RELIS.

Denne artikkelen er den tredje i en artikkelserie med tre artikler, og de to andre kan leses her:
Bli ein legemiddeldetektiv – kvifor, kva og korleis melde biverknader
Mange bekker små – bivirkningsmeldinger er nyttige og viktige!
Referenser
- Roland PDH, Aa E. Hvilke bivirkninger skal farmasøyter melde? Norsk Farmaceutisk Tidsskrift 2012; 1: 17–9.
- Statens legemiddelverk. Bivirkningsårsrapport 2020. www.legemiddelverket.no
- Roland PDH, Fleiner HF. Bivirkninger: Ny forskrift og meldeplikt for farmasøyter. Norsk Farmaceutisk Tidsskrift 2020; 2: 30–2.
- Andreassen LM, Stenberg-Nilsen H, Fleiner HF et al. Bli ein legemiddeldetektiv – kvifor, kva og korleis melde biverknader. Norsk Farmaceutisk Tidsskrift 2022; 8: 38–9.
- Nordmo E, Vorren S. Lyrica – norske bivirkningsmeldinger om misbruk. https://relis.no/artikler/29002
- Nordmo E, Vorren S. Bivirkningsrapportering nytter: pregabalin er flyttet til reseptgruppe B. Utposten 2018; 47(5): 46–7.
- Legemiddelverket. Pregabalin (Lyrica) flyttes til reseptgruppe B. (Publisert: 9. mai 2018). https://legemiddelverket.no/nyheter/pregabalin-lyrica-flyttes-til-reseptgruppe-b
- Statens legemiddelverk. Preparatomtale (SPC) Capsina. https://www.legemiddelsok.no/ (Sist oppdatert: 21. august 2020).
- Breen E, Bleday R. Approach to the patient with anal pruritus. In: UpToDate. https://www.helsebiblioteket.no/ (Sist oppdatert: 31. oktober 2022).
- Lysy L, Sistiery-Ittah M et al. Topical capsaicin – a novel and effective treatment for idiopathic intractable pruitus ani: a randomised, placebo controlled, crossover study. Gut 2003; 52: 1323–6.
- Clinical Pharmacology database. Capcaisin. Elsevier, Inc. https://www.clinicalkey.com/pharmacology/login (Sist oppdatert: 9. september 2021).
Forfattere
